যে পরিবর্তনে কোন বস্তু বা পদার্থের আণবিক গঠন সম্পূর্ণরূপে পরিবর্তিত হয়ে একটি নতুন পদার্থ তৈরি হয়, তাকে রাসায়নিক পরিবর্তন বলে। অর্থাৎ রাসায়নিক পরিবর্তন এমন একটি প্রক্রিয়া যেখানে এক বা একাধিক পদার্থ এক বা একাধিক নতুন এবং ভিন্ন পদার্থে পরিবর্তিত হয়।
রাসায়নিক পরিবর্তন একটি অপরিবর্তনীয় এবং স্থায়ী প্রক্রিয়া। পরিবর্তনের সময় পদার্থের ভর পরিবর্তিত হয়, হয় ভর যোগ করা হয় বা সরানো হয়। এছাড়া রাসায়নিক পরিবর্তনে শক্তিরও পরিবর্তন ঘটে। রাসায়নিক পরিবর্তনে তাপ শোষণ বা উৎপন্ন হতে পারে। এতে পরমাণুর সংখ্যা এবং ধরন স্থির থাকলেও তাদের বিন্যাস পরিবর্তিত হয়।
যেকোনো রাসায়নিক বিক্রিয়া রাসায়নিক পরিবর্তনের উদাহরণ। নিম্মে রাসায়নিক পরিবর্তনের উদাহরণসমূহ দেওয়া হল,
অ্যাসিড-ক্ষার বিক্রিয়া
রাসায়নিক পরিবর্তনগুলো নিম্মোক্ত বৈশিষ্ট্য দ্বারা চিহ্নিত করা যেতে পারে:
তাপমাত্রা পরিবর্তন: যেহেতু রাসায়নিক বিক্রিয়ায় শক্তির পরিবর্তন হয়, তাই প্রায়ই পরিমাপযোগ্য তাপমাত্রা পরিবর্তন হয়। তাপ শোষণ বা উৎপন্ন হতে পারে।
আলো তৈরি: কিছু রাসায়নিক বিক্রিয়া আলো তৈরি করে।
বুদবুদ: কিছু রাসায়নিক পরিবর্তন গ্যাস উৎপন্ন করে যা তরল দ্রবণে বুদবুদ হিসেবে দেখা যায়।
রঙ পরিবর্তন: রাসায়নিক পরিবর্তনে রঙ পরিবর্তন হয়ে ভিন্ন কালার সৃষ্টি হয়।
গন্ধ পরিবর্তন: রাসায়নিক বিক্রিয়ার সময় উদ্বায়ী রাসায়নিক নির্গত করতে পারে যা গন্ধ তৈরি করে।
অপরিবর্তনীয়: রাসায়নিক পরিবর্তনগুলো প্রায়শই অপরিবর্তনীয় এবং এটিকে পূর্বাস্থায় ফেরানো অসম্ভব।
গঠনে পরিবর্তন: যখন কাঠ জ্বালানো হয়, তখন এটি ছাই এ পরিণত হয়। যখন খাদ্য পচে যায়, তখন এর গঠন দৃশ্যমানভাবে পরিবর্তিত হয়। এসব গঠন পূর্বাস্থায় আনা অসম্ভব।
১. এক টুকরো লোহাকে দীর্ঘদিন বাতাসে রেখে দিলে, এটির ওপর মরিচার (ফেরিক অক্সাইড) আবরণ তৈরি হয়। লোহার সাথে বাতাসে বিদ্যমান অক্সিজেন ও জলীয়বাষ্প বিক্রিয়া করে পানিযুক্ত ফেরিক অক্সাইড (Fe2O3) উৎপন্ন করে যা মরিচা নামে পরিচিত। মরিচা লোহা হতে সম্পূর্ণ ভিন্ন। সুতরাং এটি একটি রাসায়নিক পরিবর্তন। মরিচার রাসায়নিক বিক্রিয়া হল,
4Fe(s) + 3O2(g) + 6H2O(l)→ 4Fe (OH)3(s)
২. সূর্যালোকের উপস্থিতিতে, উদ্ভিদ খাদ্য তৈরি করতে কার্বন ডাই অক্সাইড এবং পানি বিক্রিয়া করে খাদ্য (গ্লুকোজ) এবং অক্সিজেন উতপন্ন করে যা সালোকসংশ্লেষণ নামে পরিচিত। এটি দৈনন্দিন রাসায়নিক বিক্রিয়াগুলির মধ্যে সবচেয়ে গুরুত্বপূর্ণ, কারণ এইভাবে গাছপালা নিজেদের এবং প্রাণীদের জন্য খাদ্য তৈরি করে এবং কার্বন ডাই অক্সাইডকে অক্সিজেনে রূপান্তর করে। বিক্রিয়ার সমীকরণ হল:
6 CO2 + 6 H2O + আলো → C6H12O6 + 6 O2
৩. খাদ্য হজমের সময় রাসায়নিক বিক্রিয়া ঘটে। মুখের মধ্যে খাবার দেওয়ার সাথে সাথে লালার মধ্যে থাকা অ্যামাইলেজ নামক একটি এনজাইম শর্করা এবং অন্যান্য কার্বোহাইড্রেটগুলিকে আপনার শরীর শোষণ করতে পারে এমন সহজ আকারে ভেঙে দিতে শুরু করে।
আপনার পাকস্থলীতে থাকা হাইড্রোক্লোরিক অ্যাসিড খাবারের সাথে বিক্রিয়া করে এটিকে আরও ভেঙে দেয়। সবশেষে, এনজাইমগুলো প্রোটিন এবং চর্বি বিচ্ছিন্ন করে এবং রক্তের মাধ্যমে শরীরে শক্তি সঞ্চয় করে।
৪. অ্যাসিড (যেমন, ভিনেগার, লেবুর রস, সালফিউরিক অ্যাসিড) এবং ক্ষারক (যেমন, বেকিং সোডা, সাবান, অ্যামোনিয়া বা অ্যাসিটোন) একত্রিত করলে, একটি অ্যাসিড-ক্ষার বিক্রিয়া শুরু হয়। অ্যাসিড-ক্ষারকের বিক্রিয়ায় লবণ (KCl) ও পানি (H2O) উৎপাদন হয়। তাই এটি একটি রাসয়নিক পরিবর্তন। অ্যাসিড-ক্ষারকের বিক্রিয়ার সমীকরণটি হল,
HCl + KOH → KCl + H2O
৫. মোমবাতির দহন একটি রাসায়নিক পরিবর্তন। কারণ মোমবাতি জ্বলার সময় তাপে কিছু মোম গলে যায়, এটি ভৌত পরিবর্তন। কিন্তু অধিকাংশ মোম বাতাসের অক্সিজেনের সাথে বিক্রিয়া করে কার্বন ডাই অক্সাইড (CO2) ও জলীয় বাষ্প (H2O) উৎপন্ন করে। কার্বন ডাই অক্সাইড ও জলীয় বাষ্পের ধর্ম মোমের ধর্ম থেকে সম্পূর্ণ ভিন্ন। সুতরাং মোমবাতির দহন একটি রাসায়নিক পরিবর্তন।
50 mL 0.18 M CH3COOH দ্রবণে 60 mL 0.10 M NaOH দ্রবণ যোগ করা হল। pKa = 4.76.
80 mL. 0.15 M NH4OH দ্রবণে 40 mL. 0.25 M HCI দ্রবণ, যোগ করা হলো।
যখন দুই বা ততোধিক মৌল বা যৌগ রাসায়নিকভাবে মিলিত হয়ে এক বা একাধিক ভিন্ন যৌগ উৎপন্ন করে তাকে বিক্রিয়া বা রাসায়নিক বিক্রিয়া বলে। রসায়নের পরিভাষায় দুই বা ততোধিক মৌল বা যৌগের পরস্পর যুক্ত হওয়ার পদ্ধতিকে বিক্রিয়া বলে। বিক্রিয়ায় মূলত পরমানু বা ইলেকট্রনের আদান-প্রদান ঘটে।
সবুজ রসায়ন হচ্ছে, ‘শ্রমজীবী এবং ভোক্তাদের ক্ষেত্রে প্রতীয়মান ঝুঁকিপূর্ণ পদার্থের ব্যবহার এবং উৎপাদন হ্রাস অথবা অপসারণকল্পে রাসায়নিক উৎপাদ এবং প্রক্রিয়ার আবিষ্কার, ডিজাইন এবং প্রয়োগ’। অথবা, ঝুঁকিপূর্ণ পদার্থের হ্রাসকরণ অথবা, এদের ব্যবহার ও উৎপন্নের অপসারণকল্পে রাসায়নিক উৎপাদের এবং প্রক্রিয়ার ডিজাইনকে সবুজ রসায়ন বলে।
এ উদ্দেশ্য অর্জনে পাউল টি অ্যানাসতাস (Paul T. Anastas) এবং জন সি ওয়ার্নার (John C. Warner) 1991 সালে সবুজ রসায়নের ১২ টি নীতিমালা প্রণয়ন করেন। নীতিমালাসমূহকে ‘ঝুঁকি হ্রাসকরণ’ ও ‘পরিবেশগত দূষণ সীমিতকরণ’ নামক দুটি শ্রেণিতে ভাগ করা যায়।
যে বিক্রিয়ায় উৎপন্ন পদার্থগুলো তাদের আন্তঃক্রিয়ার কারণে পুনরায় মূল বিক্রিয়ক পদার্থে পরিণত হয় না, তাকে একমুখী (Irreversible) বিক্রিয়া বলে। ভিন্নভাবে বলা যায়, যে বিক্রিয়া শুধু সম্মুখদিকে অগ্রসর হয় তাকে একমুখী বিক্রিয়া বলে। এরূপ বিক্রিয়া লেখার সময় তীর (→) চিহ্ন ব্যবহার করা হয়।
উদাহরণ: (Example)
১। পটাশিয়াম ক্লোরেট (KClO3) কে খোলা পাত্রে উত্তপ্ত করলে পটাশিয়াম ক্লোরাইড (KCl) ও অক্সিজেন উৎপন্ন হয়। কিন্তু KCl ও O2 বিক্রিয়া করে পুনরায় KClO3 উৎপন্ন করে না। সুতরাং, KClO3 এর তাপীয় বিয়োজন একটি একমুখী বিক্রিয়া।
2KClO3(s)⟶Δ2KCl(s)+3O2(g)
২। অধিকাংশ আয়নিক বিক্রিয়াই একমুখী। যেমন, AgNO3 ও KCl এর জলীয় দ্রবণ পরস্পর মিশ্রিত করলে AgCl অধঃক্ষেপ পড়ে ও KNO3 উৎপন্ন হয়। কিন্তু অধঃক্ষেপ AgCl ও KNO3 পরস্পরে বিক্রিয়া করে পুনরায় AgNO3 ও KCl উৎপন্ন করে না।
AgNO3(aq)+KCl(aq)⟶AgCl(s)↓+KNO3(aq)
একমুখী বিক্রিয়ার বৈশিষ্ট্য: (Characteristics of Irreversible Reaction):
১। বিকারক পদার্থ জবা পদার্থগুলো সম্পূর্ণ বিক্রিয়া করে উৎপাদ পদার্থ উৎপন্ন করে।
২। উৎপন্ন উৎপাদ পদার্থ বা পদার্থগুলো বিভিন্ন করে পুনরায় বিকারক পদার্থে রূপান্তরিত হতে পারে না।
৩। মুক্তশক্তি পরিবর্তন (ΔG) শূন্য অপেক্ষা কম অর্থাৎ, ঋণাত্মক হয়। ΔG=−ve
কোন বিক্রিয়ায় বিক্রিয়ক পদার্থসমূহের মধ্যে বিক্রিয়ার ফলে যেমন উৎপাদ তৈরি হয়, তেমনি উৎপাদসমূহের মধ্যে বিক্রিয়ার ফলে বিক্রিয়ক পদার্থগুলো পুনরায় তৈরি হতে পারে, এরূপ বিক্রিয়াকে উভমুখী (Reversible) বিক্রিয়া বলে। প্রকৃতপক্ষে একটি উভমুখী বিক্রিয়া দুটি বিক্রিয়ার সমষ্টি। এর মধ্যে প্রথমটি সম্মুখ বিক্রিয়া এবং দ্বিতীয়টি পশ্চাৎমুখী বিক্রিয়া। এরূপ বিক্রিয়ার সমীকরণে উৎপাদ ও বিক্রিয়কের মধ্যে একটি বিপরীতমুখী জোড়া তীর চিহ্ন (⇌) থাকে। যেমন, 2HI⇌H2+I2
এই বিক্রিয়ার সম্মুখমুখী বিক্রিয়া হলো 2HI→H2+I2 এবং বিক্রিয়াটির পশ্চাৎমুখী বিক্রিয়া হলো 2HI→H2+I2 নিচে উভমুখী বিক্রিয়ার আরও কয়েকটি উদাহরণ দেয়া হলো :
N2+3H2⇌2NH3;NH3+HCl⇌NH4Cl;PCl5⇌PCl3+Cl2
উভমুখী বিক্রিয়ার বৈশিষ্ট্য (Characteristics of Reversible Reaction):
১। উভমুখী বিক্রিয়ায় সম্মুখ ও বিপরীত দিকে বিক্রিয়া একই সাথে সংঘটিত হয়।
২। উভমুখী বিক্রিয়া অসম্পূর্ণতার জন্য এ ধরণের বিক্রিয়ায় বিক্রিয়কগুলো কখনোই নিঃশেষিত হয় না।
৩। এ ধরণের বিক্রিয়ায় সম্মুখ ও বিপরীত দিকে বিক্রিয়ার হার সমান হলে বিক্রিয়াটি সাম্যাবস্থা অর্জন করে।
৪। ΔG=0।
উভমুখী বিক্রিয়াকে একমুখী করার উপায় (Way to make Reversible Reaction as Irreversible Reaction): উভমুখী বিক্রিয়াকে বিভিন্নভাবে একমুখী করা যায়। কারণ, উভমুখী বিক্রিয়া অসম্পূর্ণ। যেমন, কোন বিক্রিয়ার একটি উৎপাদকে যদি ক্রমাগত বিক্রিয়াস্থল থেকে সরিয়ে নেওয়া যায়, তাহলে বিপরীত বিক্রিয়াটি সংঘটিত হতে পারে না। অর্থাৎ, তখন উভমুখী সাম্যাবস্থা আর থাকে না।
এ সংক্রান্ত কতিপয় উদাহরণ হচ্ছে (Few Examples):
১। বিক্রিয়কগুলো যদি কঠিন অথবা তরল হয় এবং একটি উৎপাদ গ্যাসীয় হলে তা সহজেই বিক্রিয়াস্থল থেকে অপসারিত হয়ে পড়ে। ফলে উভমুখী বিক্রিয়াটি একমুখী হয়। যেমন, বদ্ধ পাত্রে ক্যালসিয়াম কার্বনেটের তাপীয় বিয়োজন উভমুখী; কিন্তু খোলা পাত্রে ও বিক্রিয়া চালালে বিক্রিয়াটি একমুখী হয়। কারণ উৎপাদ CO2 গ্যাস উৎপন্ন হওয়ার সাথে সাথেই বিক্রিয়া বিক্রিয়াস্থল ত্যাগ করে যায়।
CaCO3(s)⇋ΔCaO(s)+CO2(g)(বদ্ধপাত্রে);CaCO3(s)⟶ΔCaCO(s)+CO2(g)(খোলাপাত্রে)
২। কোন বিক্রিয়ার দ্রবণ থেকে একটি উৎপাদ অধঃক্ষিপ্ত হলে বিক্রিয়াটি একমুখী হয়। যেমন, সোডিয়াম সালফেটের দ্রবণে বেরিয়াম ক্লোরাইডের দ্রবণ যোগ করলে বেরিয়াম সালফেটের অধঃক্ষেপ উৎপন্ন হয়।
Na2SO4(aq)+BaCl2(aq)⟶BaSO4(s)+2NaCl(aq)
3। বিক্রিয়ার পরিবেশ থেকে কোন উৎপাদকে রাসায়নিকভাবে সরিয়ে নেয়া হলে উভমুখী বিক্রিয়া একমুখী হয়। যেমন, ইথাইল ইথানয়েট এর সাথে পানির বিক্রিয়ায় ইথানল ও ইথানোয়িক এসিড উৎপন্ন হয়। এ বিক্রিয়া একটি উভমুখী বিক্রিয়া।
CH3COOHC2H5+H2O⇋C2H5OH+CH3COOH
ইথাইল ইথানয়েট পানি ইথানল ইথানোয়িক এসিড
বিক্রিয়ার মিশ্রণের মধ্যে সোডিয়াম হাইড্রোক্সাইড যোগ করলে, তা সাথে সাথে উৎপাদিত ইথানোয়িক এসিডের সাথে বিক্রিয়া করে সোডিয়াম ইথানোয়েট ও পানি উৎপন্ন করে। ফলে বিপরীত বিক্রিয়া সংঘটিত হতে পারে না। তখন সম্পূর্ণ বিক্রিয়াকে নিম্নলিখিতভাবে প্রকাশ করা যায়।
যোগ করে, CH3COOHC2H5CH3COOHCH3COOC2H5 ইথাইল ইথানোয়েট +H2O⟶CH3COOH+NaOH⟶CH3COONa+NaOH⟶C2H5OH ইথানল +C2H5OH+H2O+CH3COONa সোডিয়াম ইথানেট
একটি একমুখী বিক্রিয়াকে উভমুখী বিক্রিয়ায় রূপান্তর করা সম্ভব হলে তা সাধারণত তাপমাত্রা, চাপ বা অনুঘটকের উপস্থিতি দ্বারা নিয়ন্ত্রিত হয়। যখন একটি বিক্রিয়ার পণ্যগুলো আবার বিক্রিয়ারত পদার্থে পরিণত হতে পারে, তখন সেটি উভমুখী বিক্রিয়া হয়ে যায়। উদাহরণ:
N2+3H2=2NH3
এই বিক্রিয়া উভমুখী হতে উচ্চ চাপ ও অনুঘটকের প্রয়োজন হয়।
উভমুখী বিক্রিয়াকে একমুখী বিক্রিয়ায় রূপান্তরের জন্য বিক্রিয়ার কোনো একটি পণ্যকে সিস্টেম থেকে অপসারণ করা হয়। এতে সমীকরণে ভারসাম্য পরিবর্তিত হয়ে বিক্রিয়াটি একমুখী হয়ে যায়। উদাহরণ:
CaCO3 => CaO +CO2
যদি CO2 গ্যাসকে অপসারণ করা হয়, তবে বিক্রিয়াটি একমুখী হয়ে যায়।
একটি নির্দিষ্ট তাপমাত্রায় একক ঘনমাত্রার বিক্রিয়কসমূহের বিক্রিয়ার হারকে ঐ তাপমাত্রায় প্রদত্ত বিক্রিয়ার হার ধ্রুবক বলে। একটি নির্দিষ্ট তাপমাত্রায় বিক্রিয়কগুলোর একক ঘনমাত্রায়, কোনো বিক্রিয়ার হার কিরূপ হবে তা বিক্রিয়াটির হার ধ্রুবক দ্বারা প্রকাশ করা যায়।
উদাহরণ (Example):
একটি সাধারণ বিক্রিয়া aA+bB→cC+dD বিবেচনা করা যাক। যদি বিক্রিয়াটি হার সমীকরণে বিক্রিয়ক A ও B এর ঘনমাত্রার ঘাত (Power) a ও b হয় তবে বিক্রিয়াটির হার α[A]a[B]b বা, বিক্রিয়ার হার=k[A]a[B]b, এখানে k একটি ধ্রুবক, একে বিক্রিয়ার হার ধ্রুবক বলে। যদি প্রতিটি বিক্রিয়কের ঘনমাত্রা একক হয় অর্থাৎ, [A]=1M এবং [B]=1M হয় তবে বিক্রিয়ার হার =k।
হার ধ্রুবকের বৈশিষ্ট্য (Characteristics of Constant Reaction Rate):
(ক) একটি নির্দিষ্ট বিক্রিয়ার ক্ষেত্রে নির্দিষ্ট তাপমাত্রায় হার ধ্রুবকের মান নির্দিষ্ট হয়।
(খ) একটি নির্দিষ্ট বিক্রিয়ার ক্ষেত্রে হার ধ্রুবকের মান বিক্রিয়কের ঘনমাত্রার উপর নির্ভর করে না।
(গ) কোন বিক্রিয়ার হার ধ্রুবকের মান জানা থাকলে বিক্রিয়ার হার সম্পর্কে ধারণা পাওয়া যায়। যেমন, হার ধ্রুবকের মান বেশি হলে বিক্রিয়ার হার বেশি হয় এবং হার ধ্রুবকের মান কম হলে বিক্রিয়ার হার কম হয়।
বিক্রিয়ার হার (Rate of Reaction)
বিক্রিয়ার হার একটি রাসায়নিক বিক্রিয়ায় প্রতিক্রিয়াশীল পদার্থের ঘনমাত্রার পরিবর্তনের হারকে বোঝায়। এটি সাধারণত সময়ের সাথে সংশ্লিষ্ট।
বিক্রিয়ার হার সমীকরণ
বিক্রিয়ার হার নির্ণয়ে নিচের সাধারণ সমীকরণ ব্যবহার করা হয়:
![]()
যেখানে:
বিক্রিয়ার মোট ঘাত নির্ধারণ
m এবং n -এর যোগফল বিক্রিয়ার মোট ঘাত (Overall order of reaction) নির্ধারণ করে।
উদাহরণ:
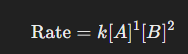
এখানে বিক্রিয়ার মোট ঘাত = ( 1 + 2 = 3 )।
ধ্রুবক k -এর উপর নির্ভরশীলতা
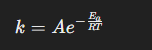
যেখানে:
উদাহরণ
১. প্রথম ঘাতের বিক্রিয়া
![]()
এখানে বিক্রিয়ার হার A -এর ঘনমাত্রার সাথে সরাসরি সমানুপাতিক।
২. দ্বিতীয় ঘাতের বিক্রিয়া
![]()
এখানে বিক্রিয়ার হার A -এর ঘনমাত্রার বর্গের সাথে সমানুপাতিক।
তাপোউৎপাদী বিক্রিয়া (Exothermic Reaction) এমন একটি রাসায়নিক বিক্রিয়া যেখানে বিক্রিয়ার ফলে তাপ উৎপন্ন হয় এবং চারপাশে ছড়িয়ে পড়ে। এ ধরনের বিক্রিয়ায় পণ্য (Products)-এর শক্তি বিক্রিয়ারকের (Reactants)-এর শক্তি থেকে কম থাকে।
সক্রিয়ণ শক্তি (Activation Energy) হলো বিক্রিয়ারকের অণুগুলোকে পণ্য তৈরি করার জন্য সক্রিয় অবস্থায় আনতে প্রয়োজনীয় সর্বনিম্ন শক্তি।
তাপোউৎপাদী বিক্রিয়ার ক্ষেত্রে সক্রিয়ণ শক্তি তুলনামূলকভাবে কম হতে পারে, কারণ বিক্রিয়ার সময় শক্তি মুক্ত হয় যা বিক্রিয়ার ধারাবাহিকতা বজায় রাখতে সহায়তা করে।
তাপহারী বিক্রিয়া (Endothermic Reaction) এমন একটি বিক্রিয়া যেখানে বিক্রিয়ার জন্য তাপের শোষণ প্রয়োজন। এ ধরনের বিক্রিয়ায় পণ্যের শক্তি বিক্রিয়ারকের শক্তি থেকে বেশি থাকে।
তাপহারী বিক্রিয়ার সক্রিয়ণ শক্তি সাধারণত বেশি হয়, কারণ বিক্রিয়ারকারক অণুগুলোকে পণ্য তৈরি করার জন্য প্রয়োজনীয় শক্তি বহিরাগত তাপ থেকে গ্রহণ করতে হয়।
| বৈশিষ্ট্য | তাপোউৎপাদী বিক্রিয়া | তাপহারী বিক্রিয়া |
|---|---|---|
| শক্তির প্রবাহ | শক্তি মুক্ত হয় | শক্তি শোষিত হয় |
| সক্রিয়ণ শক্তি | তুলনামূলক কম | তুলনামূলক বেশি |
| বিক্রিয়ার তাপমাত্রা প্রভাব | তাপমাত্রা বৃদ্ধি বিক্রিয়ার হার বাড়ায় | তাপমাত্রা বৃদ্ধি বিক্রিয়ার হার বাড়ায় |
তাপোউৎপাদী ও তাপহারী বিক্রিয়ার মধ্যে সক্রিয়ণ শক্তি তাদের শক্তি গ্রহণ ও মুক্ত করার প্রক্রিয়ায় গুরুত্বপূর্ণ ভূমিকা পালন করে। তাপোউৎপাদী বিক্রিয়ায় সক্রিয়ণ শক্তি কম থাকে, কারণ বিক্রিয়ার সময় মুক্ত হওয়া শক্তি প্রক্রিয়াটিকে সহজতর করে। অন্যদিকে, তাপহারী বিক্রিয়ায় সক্রিয়ণ শক্তি বেশি প্রয়োজন হয়, কারণ এটি বহিরাগত তাপ শোষণের মাধ্যমে প্রক্রিয়াকে চালিত করে।
সংঘর্ষ তত্ত্ব (Collision Theory) রাসায়নিক বিক্রিয়ার হার ব্যাখ্যা করার জন্য একটি গুরুত্বপূর্ণ তত্ত্ব। এটি বলে যে রাসায়নিক বিক্রিয়া তখনই ঘটে যখন প্রতিক্রিয়াশীল কণাগুলো যথেষ্ট শক্তি এবং সঠিক দিকনির্দেশে সংঘর্ষ করে।
১. কার্যকর সংঘর্ষ:
২. শক্তির প্রয়োজনীয়তা (সক্রিয়ণ শক্তি):
৩. সংঘর্ষের হার:
১. তাপমাত্রা:
তাপমাত্রা বাড়লে কণাগুলোর গতি বৃদ্ধি পায়, ফলে সংঘর্ষের হার এবং কার্যকর সংঘর্ষের সম্ভাবনা বাড়ে।
২. ঘনত্ব:
প্রতিক্রিয়াশীল কণার ঘনত্ব বাড়লে সংঘর্ষের সম্ভাবনা বাড়ে।
৩. অনুঘটক (Catalyst):
অনুঘটক সক্রিয়ণ শক্তি কমিয়ে কার্যকর সংঘর্ষের হার বাড়ায়।
৪. পৃষ্ঠের ক্ষেত্রফল:
পৃষ্ঠের ক্ষেত্রফল বেশি হলে সংঘর্ষের সম্ভাবনা বৃদ্ধি পায়।
রাসায়নিক বিক্রিয়ার অবস্থানান্তর অবস্থা তত্ত্ব (Transition State Theory) রাসায়নিক কাইনেটিক্সের একটি গুরুত্বপূর্ণ দিক। এই তত্ত্ব রাসায়নিক বিক্রিয়ার গতি এবং বিক্রিয়ার প্রক্রিয়ায় শক্তি পরিবর্তনের ব্যাখ্যা প্রদান করে।
অবস্থানান্তর অবস্থা তত্ত্ব অনুযায়ী, রাসায়নিক বিক্রিয়ার সময় প্রতিক্রিয়ার পথ ধরে একধরনের অস্থায়ী এবং উচ্চ-শক্তিসম্পন্ন অবস্থা সৃষ্টি হয়। এই অবস্থাটি "অবস্থানান্তর অবস্থা" (Transition State) নামে পরিচিত। এটি এমন একটি বিন্দু যেখানে প্রতিক্রিয়ার সময় পুরনো বন্ধনগুলো ভাঙতে শুরু করে এবং নতুন বন্ধনগুলো গঠিত হতে শুরু করে।
অবস্থানান্তর অবস্থায় পৌঁছানোর জন্য প্রতিক্রিয়ার অংশগ্রহণকারী অণুগুলোকে সক্রিয়ন শক্তি (Activation Energy) অতিক্রম করতে হয়। সক্রিয়ন শক্তি হচ্ছে সেই সর্বনিম্ন শক্তি যা একটি বিক্রিয়া শুরু করার জন্য প্রয়োজন।
রাসায়নিক বিক্রিয়ার গতি নির্ণয় এবং বিক্রিয়ার পদ্ধতি ব্যাখ্যা করতে অবস্থানান্তর অবস্থা তত্ত্ব ব্যাপকভাবে ব্যবহৃত হয়। এটি শিল্পক্ষেত্রে বিভিন্ন রাসায়নিক বিক্রিয়ার কৌশল উন্নত করতে সাহায্য করে।
সারসংক্ষেপ
অবস্থানান্তর অবস্থা তত্ত্ব রাসায়নিক বিক্রিয়ার প্রক্রিয়া এবং শক্তি পরিবর্তন বোঝাতে অত্যন্ত কার্যকর। এটি রাসায়নিক গবেষণার বিভিন্ন শাখায় নতুন দিগন্ত উন্মোচন করেছে।
প্রভাবনের ক্রিয়া কৌশল হলো এমন একটি প্রক্রিয়া, যার মাধ্যমে কোনো নিরপেক্ষ বস্তুতে বিদ্যমান চার্জযুক্ত বস্তুর প্রভাবে বৈদ্যুতিক চার্জ সৃষ্টি হয়। এটি একটি অ-পরিচালক সংযোগহীন প্রক্রিয়া যেখানে চার্জ এক প্রান্তে সঞ্চিত হয়।
রাসায়নিক বিক্রিয়ায় প্রভাবক (Catalyst) এমন একটি পদার্থ যা বিক্রিয়ার গতি বৃদ্ধি করে, কিন্তু নিজে বিক্রিয়ায় পরিবর্তিত হয় না। এটি সক্রিয়ণ শক্তি (Activation Energy) কমিয়ে বিক্রিয়ার পথ সহজ করে দেয়।
| বিনাপ্রভাবক বিক্রিয়া | প্রভাবকসহ বিক্রিয়া |
|---|---|
| সক্রিয়ণ শক্তি বেশি | সক্রিয়ণ শক্তি কম |
| বিক্রিয়া ধীরগতি সম্পন্ন | বিক্রিয়া দ্রুত সম্পন্ন |
| বিকল্প পথ নেই | বিকল্প পথ তৈরি হয় |
এনজাইমের সংজ্ঞা ও কার্যপ্রক্রিয়া
এনজাইম হলো প্রোটিন-ভিত্তিক জৈব প্রভাবক যা জৈব রাসায়নিক বিক্রিয়াগুলোর গতি বাড়াতে সাহায্য করে। এটি প্রতিক্রিয়ায় অংশ নিলেও নিজে অপরিবর্তিত থাকে। এনজাইম সুনির্দিষ্ট সাবস্ট্রেটের সঙ্গে মিথস্ক্রিয়া করে একটি এনজাইম-সাবস্ট্রেট কমপ্লেক্স তৈরি করে এবং বিক্রিয়া সম্পন্ন করে।
জৈব প্রভাবকের বৈশিষ্ট্য
১. সুনির্দিষ্টতা:
প্রতিটি এনজাইম একটি নির্দিষ্ট সাবস্ট্রেটের জন্য কাজ করে।
২. তাপমাত্রার প্রভাব:
নির্দিষ্ট তাপমাত্রা (অপটিমাম তাপমাত্রা) এর মধ্যে এনজাইম সবচেয়ে ভালো কাজ করে।
৩. pH এর প্রভাব:
প্রতিটি এনজাইমের নির্দিষ্ট pH মান থাকে যেখানে এটি কার্যকর থাকে।
৪. ক্যাটালাইটিক ক্ষমতা:
অল্প পরিমাণ এনজাইম বৃহৎ পরিমাণ সাবস্ট্রেটের বিক্রিয়াকে ত্বরান্বিত করতে পারে।
এনজাইমের কার্যপ্রক্রিয়া ধাপসমূহ
১. সাবস্ট্রেট বাঁধন:
এনজাইমের সক্রিয় সাইট সাবস্ট্রেটের সঙ্গে যুক্ত হয়।
২. এনজাইম-সাবস্ট্রেট কমপ্লেক্স:
এনজাইম ও সাবস্ট্রেট একটি স্থিতিশীল জটিল তৈরি করে।
৩. রাসায়নিক বিক্রিয়া:
সাবস্ট্রেট এনজাইমের উপস্থিতিতে রূপান্তরিত হয়।
৪. পণ্য মুক্তি:
বিক্রিয়া শেষে পণ্য আলাদা হয়ে যায়, এবং এনজাইম নতুন বিক্রিয়ার জন্য প্রস্তুত থাকে।
উদাহরণ
১. অ্যামিলেজ: মুখে থাকা এনজাইম যা শর্করা ভাঙতে সাহায্য করে।
২. লিপেজ: চর্বি বা লিপিড ভাঙার এনজাইম।
৩. প্রোটেজ: প্রোটিন ভেঙে অ্যামিনো অ্যাসিডে রূপান্তরিত করে।
রাসায়নিক সাম্যাবস্থা মানে এমন একটি অবস্থান যেখানে বিক্রিয়ার হার সামঞ্জস্যপূর্ণ থাকে। এই অবস্থায় বিক্রিয়া থেমে থাকে না; বরং বিক্রিয়ার জন্য এগিয়ে যাওয়া এবং ফিরে আসা, উভয় প্রক্রিয়াই চলমান থাকে, তবে তাদের হার সমান হয়ে যায়। এটি একটি গতিশীল প্রক্রিয়া, কারণ বিক্রিয়ার সামগ্রিক পরিবর্তন দৃশ্যমান হয় না।
N2+3H2=2NH3
এই বিক্রিয়ায় সাম্যাবস্থা স্থাপন হলে NH₃ গঠনের হার এবং তার ভাঙনের হা থাকে। ফলে সিস্টেমের মোট পরিবর্তন দৃশ্যমান হয় না।
কোন উভমুখী বিক্রিয়া সাম্যাবস্থায় থাকাকালে যদি ঐ অবস্থার একটি নিয়ামক (যেমন তাপমাত্রা, চাপ, ঘনমাত্রা) পরিবর্তন করা হয় তবে সাম্যের অবস্থান এমনভাবে পরিবর্তন হয় যাতে নিয়ামক পরিবর্তনের ফলাফল প্রশমিত হয়।
তাপমাত্রার প্রভাব (Effect of heat): তাপমাত্রার পরিবর্তনের ফলে সাম্যবস্থা এবং সাম্যধ্রুবক উভয়েরই পরিবর্তন ঘটে। তাপের পরিবর্তনের ফলে সাম্যবস্থার কী পরিবর্তন হয় তা লা-শাতেলীয় নীতি অনুসারে নিয়ে আলোচনা করা হল।
তাপোৎপাদী বিক্রিয়া (Exothermic reaction): এ ধরনের বিক্রিয়ার ক্ষেত্রে সাম্যবস্থায় তাপমাত্রা বাড়ালে লা-শাতেলীয় নীতি অনুযায়ী এর সাম্যবস্থা পশ্চাৎমুখী হবে। কারণ, পশ্চাৎমুখী বিক্রিয়ায় উৎপাদ তাপের সাহায্যে বিয়োজিত হয়ে বিক্রিয়কে পরিণত হবে। এর ফলে তাপ হ্রাস পায় তথা তাপমাত্রা হ্রাস পাবে। ফলে তাপমাত্রা বৃদ্ধির ফলাফল প্রশমিত হবে। অর্থাৎ, এ ধরনের বিক্রিয়ায় তাপমাত্রা বৃদ্ধি করলে উৎপাদের পরিমাণ হ্রাস পায় অর্থাৎ অধিকতর উৎপাদের জন্য অনুকূল নয়। যদি তাপমাত্রা হ্রাস করা হয় তাহলে সাম্যাবস্থা বাম থেকে ডানদিকে সরে যাবে । বিক্রিয়ক উৎপাদে পরিণত হওয়ার সময় তাপ উৎপন্ন হয় এতে তাপ হ্রাস অথবা তাপমাত্রা হ্রাসের ফলাফল প্রশমিত হবে।
অর্থাৎ, এ ধরনের বিক্রিয়ার ক্ষেত্রে তাপমাত্রা হ্রাস করলে তা অধিকতর উৎপাদের জন্য অনুকূল অবস্থার হবে। তবে তাপমাত্রা বেশী হ্রাস করলে বিক্রিয়ার হার কমবে উৎপাদ কম হবে। তাই এক্ষেত্রে অত্যানুকুল তাপমাত্রা নির্ধারণ করতে হবে। যেমন-
N2+3H2⇌2NH3;ΔH=92.2KJ/mol
তাপহারী বিক্রিয়ার ক্ষেত্রে (Endothermic Reaction): এ ধরনের বিক্রিয়ার ক্ষেত্রে সাম্যবস্থায় তাপমাত্রা বাড়ালে লা-শাতেলীয় নীতি অনুযায়ী তাপমাত্রা হ্রাসের জন্য বিক্রিয়াটির সাম্যবস্থা বাম থেকে ডানে স্থানান্তরিত হবে। কারণ সাম্যাবস্থায় বিক্রিয়ায় বিক্রিয়ক তাপের সাহায্যে বিয়োজিত হয়ে উৎপাদে পরিণত হবে। এর ফলে তাপ হ্রাস পাবে তথা তাপমাত্রা হ্রাস পাবে। ফলে তাপমাত্রা বৃদ্ধির ফলাফল প্রশমিত হবে। অর্থাৎ, এ ধরনের বিক্রিয়ায় তাপমাত্রা বৃদ্ধি করলে উৎপাদের পরিমাণ বৃদ্ধি পাবে। তবে উচ্চ তাপের ফলে উৎপাদ বিয়োজিত হতে পারে এবং অর্থনৈতিকভাবে কম লাভজনক হবে। তাই এক্ষেত্রেও অত্যানুকুল তাপমাত্রা বিবেচনা করতে হবে। যদি তাপমাত্রা হ্রাস করা হয়, তাহলে সাম্যবস্থা ডান থেকে বামে যাবে। কারণ পশ্চাৎমুখী বিক্রিয়ার মাধ্যমে উৎপাদ বিক্রিয়কে পরিণত হয়ে তাপ উৎপন্ন করবে। এতে তাপ হ্রাসের ফলাফল প্রশমিত হবে। অর্থাৎ, এ ধরনের বিক্রিয়ায় তাপমাত্রা হ্রাস করলে তা অধিকতর উৎপাদের জন্য অনুকূল নয়।
N2+02⇌2NO;ΔH=+180KJ
চাপের প্রভাব (Effect of Pressure): কঠিন এবং তরল সাম্যবস্থার উপর চাপের কোনো প্রভাব নেই।যে সমস্ত গ্যাসীয় বিক্রিয়ায় Δn এর মান শূণ্য হয় সেক্ষেত্রেও চাপের কোনো প্রভাব নেই। গ্যাসীয় বিক্রিয়ায় মোল সংখ্যার পার্থক্য হলে চাপের প্রভাব থাকবে।
(i) উৎপাদের মোল সংখ্যা বিক্রিয়কের মোল সংখ্যা অপেক্ষা বেশি হলে অর্থাৎ, Δn ধণাত্মক হয় । যদি বিক্রিয়ক অপেক্ষা উৎপাদের গ্যাসীয় মোল সংখ্যা বেশি হয় তখন আবদ্ধ পাত্রে একই আয়তনে চাপ বাড়ে। অর্থাৎ, মোল সংখ্যা বৃদ্ধি পাওয়ার কারণে চাপ বৃদ্ধি পায়। এক্ষেত্রে চাপ বৃদ্ধি করলে লা-শাতেলীয় নীতি অনুযায়ী এর সাম্যবস্থা ডান থেকে বামে যাবে। অর্থাৎ, পশ্চাৎম্মুখী হবে। বিক্রিয়ার ফলে মোল সংখ্যা হ্রাস পাবে। চাপ হ্রাস পাবে এবং চাপ বৃদ্ধির ফলাফল প্রশমিত হবে। অর্থাৎ, এ ধরনের বিক্রিয়ার ক্ষেত্রে চাপ বাড়ালে তা অধিক উৎপাদের জন্য অনুকূল অবস্থা নয় বোঝায়। অপরদিকে চাপ হ্রাস করলে সম্মুখমূখী বিক্রিয়ার মাধ্যমে মোল সংখ্যা বৃদ্ধি পাবে, চাপ বৃদ্ধি পাবে।
ফলে চাপ হ্রাসের ফলাফল প্রশমিত হবে। অর্থাৎ, এ ধরনের বিক্রিয়ার ক্ষেত্রে চাপ হ্রাস করলে তা অধিকতর উৎপাদের জন্য অনুকূল হবে।
N2O2⇌2NO2
(ii) উৎপাদের মোলসংখ্যা হ্রাস পেলে: Δn এর মান ঋণাত্মক হলে এ ধরনের বিক্রিয়ার ক্ষেত্রে উৎপাদের মোলসংখ্যা কম হওয়ায়, আবদ্ধ পাত্রে একই আয়তনে চাপ হ্রাস পায়। এক্ষেত্রে চাপ বৃদ্ধি করলে লা-শাতেলীয় নীতি অনুযায়ী চাপ হ্রাস করার জন্য সাম্যবস্থায় বাম থেকে ডানে যাবে। কারণ সম্মুখমূখী বিক্রিয়ার ফলে মোল সংখ্যা হ্রাস পায়। ফলে চাপ হ্রাস পায় এবং চাপ বৃদ্ধির ফলাফল প্রশমিত হয়। অর্থাৎ, এ ধরনের বিক্রিয়ার ক্ষেত্রে চাপ বাড়লে তা অধিক উৎপাদের জন্য অনুকূল অবস্থা বোঝায়। তবে অত্যাধিক চাপ ব্যবহার অর্থনৈতিকভাবে লাভজনক নয় তাই অনুকুল চাপ ব্যবহার করতে হবে। অপরদিকে চাপ হ্রাস করলে পশ্চাৎমূখী বিক্রিয়ার মাধ্যমে মোল সংখ্যা বাড়লে এতে চাপ বৃদ্ধি পায় ফলে চাপ হ্রাসের ফলাফল প্রশমিত হবে।
অপরদিকে চাপ হ্রাস করলে পশ্চাৎমূখী বিক্রিয়ার মাধ্যমে মোল সংখ্যা বাড়লে এতে চাপ বৃদ্ধি পায় ফলে চাপ হ্রাসের ফলাফল প্রশমিত হবে। এ অবস্থাটি অধিকতর উৎপাদের জন্য অনুকুলের নয় বোঝায়-
N2(g)+3H2;(g)⇌2NH3(g)
ঘনমাত্রার প্রভাব (Effect of density): একটি নির্দিষ্ট তাপমাত্রায় কোনো বিক্রিয়া সাম্যবস্থায় থাকাকালে বিক্রিয়কের ঘনমাত্রা বৃদ্ধি করলে সাম্যধ্রুবকের মান স্থির রাখার জন্য বিক্রিয়াটি সম্মুখমূখী হবে। একইভাবে উৎপাদের ঘনমাত্রা বৃদ্ধি করলে সাম্যধ্রুবকের মান স্থির রাখার জন্য সাম্যাবস্থা বাম দিকে সরে যাবে। যেমন-
A⇌B
যেমন- এই বিক্রিয়ার KC=[A][B]
গ্যাসীয় সাম্যাবস্থায় ক্ষেত্রে গ্যাসীয় উৎপাদকে শীতলীকরণের মাধ্যমে তরলে পরিণত করা হলে বিক্রিয়াটি সম্মুখমুখী হবে এবং উৎপাদের পরিমাণ বৃদ্ধি পাবে। এক্ষেত্রে A এর ঘনমাত্রা বৃদ্ধি করা হলে নির্দিষ্ট তাপমাত্রায় KC এর মান ধ্রুবক রাখার জন্য A বিয়োজিত হয়ে B তে পরিণত হবে। অর্থাৎ, সাম্যাবস্থা ডানদিকে সরে যাবে। একইভাবে, উৎপাদের ঘনমাত্রা বৃদ্ধি করলে সাম্যাবস্থা বাম দিকে সরে যাবে।
তাপমাত্রা পরিবর্তন করলে সাম্যাবস্থার এবং সাম্যধ্রুবক উভয়ের পরিবর্তন ঘটে। সাম্যাঙ্কের উপর তাপমাত্রার প্রভাব বিজ্ঞানী ভ্যান্ট হফ এর সমীকরণ দ্বারা ব্যাখ্যা করা যায়। সমীকরণটি নিমরূপ:
logKP=2.303R−ΔH×T1+ ধ্রুবক………….(i)
(i) নং সমীকরণ y=mx+c ধরনের সরলরেখার সমীকরণ। তাই logKP এর বিপরীতে । এর মান বসালে নিম্নরূপ ২ ধরনের লেখচিত্র পাওয়া যায়।
(১) তাপহারী বিক্রিয়ার ক্ষেত্রে (Endothermic Reaction)-
এক্ষেত্রে তাপমাত্রা T বৃদ্ধি পেলে T1 এর মান হ্রাস পায় এবং logKP এর মান সেই অনুযায়ী বৃদ্ধি পায়। অর্থাৎ, এ ধরনের বিক্রিয়ার ক্ষেত্রে তাপমাত্রা বৃদ্ধি করলে সামপ্রুবক Kp এর মান বৃদ্ধি পায়।
আবার, তাপমাত্রা হ্রাস করলে সামাধ্রুবকের মান হ্রাস পায়। যেমন-
N2O4⇌Δ2NO2;ΔH=+180KJmol−1
ঢাল =2.303R−ΔH (এক্ষেত্রে ঢালের মান ঋণাত্মক হয় বলে ΔH এর মান ধনাত্মক হয়। যা থেকে বুঝা যায় যে বিক্রিয়া তাপহারী হবে।)
(২) তাপউৎপাদী বিক্রিয়ার ক্ষেত্রে (Exothermic reaction)-
এক্ষেত্রে তাপমাত্রা T বৃদ্ধি করলে T1 এর মান হ্রাস পায় এবং logKP এর মান হ্রাস পায় অর্থাৎ, তাপউৎপাদী বিক্রিয়ার ক্ষেত্রে তাপমাত্রা বাড়ালে সাম্যধ্রুবকের মান হ্রাস পায়। অপরদিকে হ্রাস করলে সাম্যধ্রুবকের মান বৃদ্ধি পায়। এক্ষেত্রে বিক্রিয়ার ঢাল এর মান ধনাত্মক হওয়ায় ΔH এর মান ঋণাত্মক হবে যা থেকে বোঝা যায় বিক্রিয়াটি তাপউৎপাদী।
N2+3H2⇌2NH3;ΔH=−92.2KImol−1
কোনো উভমুখী বিক্রিয়ার সাম্যাবস্থার উপর চাপের প্রভাব থাকবে যদি ও কেবল যদি-
১. বিক্রিয়ক ও উৎপাদ উভয়ই গ্যাসীয় অবস্থায় থাকে।
২. বিক্রিয়ক ও উৎপাদের মোট মোলার আয়তনের পরিবর্তন থাকতে হবে।
বিক্রিয়কের মোট মোলসংখ্যা উৎপাদের মোট মোলসংখ্যা থেকে বেশি হলে,
১. চাপ বৃদ্ধি পেলে → বিক্রিয়াটির গ্যাসীয় উপাদান বেশি মোল থেকে কম মোলের দিকে যাবে। অর্থাৎ বিক্রিয়াটি সম্মুখদিকে অগ্রসর হবে।
২. চাপ হ্রাস পেলে → বিক্রিয়াটির গ্যাসীয় উপাদান কম মোল থেকে বেশি মোলের দিকে যাবে। অর্থাৎ বিক্রিয়াটি পশ্চাৎদিকে আগাবে।
যেমন:
CO(g)+2H2(g)⇌CH3OH(g)
বিক্রিয়াটিতে বিক্রিয়ক ও উৎপাদ উভয়ই গ্যাসীয় অবস্থায় আছে। বিক্রিয়ক ও উৎপাদের মোলসংখ্যা ভিন্ন। সুতরাং বিক্রিয়ার সাম্যাবস্থায় চাপের প্রভাব আছে।
বিক্রিয়কের মোলসংখ্যা= 1+2=3 উৎপাদের মোলসংখ্যা=1। অর্থাৎ বিক্রিয়কের মোলসংখ্যা উৎপাদের মোলসংখ্যা হতে বেশি। এক্ষেত্রে সাম্যাবস্থায় চাপ বৃদ্ধি করলে বিক্রিয়াটি সম্মুখদিকে অগ্রসর হবে এবং চাপ হ্রাস করে চাপ বৃদ্ধির ফলাফল প্রশমিত করবে।
চাপ হ্রাস করলে বিক্রিয়াটি পশ্চাৎদিকে অগ্রসর হবে এবং চাপ বৃদ্ধি করে চাপ হ্রাসের ফলাফল প্রশমিত করবে।
বিক্রিয়কের মোট মোলসংখ্যা উৎপাদের মোট মোলসংখ্যা হতে কম হলে,
চাপ বৃদ্ধি পেলে → বিক্রিয়াটির গ্যাসীয় উপাদান বেশি মোলসংখ্যা থেকে কম মোলসংখ্যার দিকে যাবে। অর্থাৎ বিক্রিয়াটি পশ্চাৎদিকে আগাবে।
চাপ হ্রাস পেলে → বিক্রিয়াটির গ্যাসীয় উপাদান কম মোলসংখ্যা থেকে বেশি মোলসংখ্যার দিকে যাবে। অর্থাৎ বিক্রিয়াটি সম্মুখদিকে অগ্রসর হবে।
2NH3(g)⇌N2(g)+3H2(g)
যেহেতু বিক্রিয়ক ও উৎপাদ উভয়ই গ্যাসীয় অবস্থায় আছে এবং বিক্রিয়ক ও উৎপাদের মোলসংখ্যা ভিন্ন সেহেতু বিক্রিয়ার উপর চাপের প্রভাব আছে।
এখানে বিক্রিয়কের মোলসংখ্যা=2 উৎপাদের মোলসংখ্যা= 1+3=4। অর্থাৎ বিক্রিয়কের মোল সংখ্যা উৎপাদের মোল সংখ্যা অপেক্ষা কম। এক্ষেত্রে সাম্যাবস্থায় চাপ বৃদ্ধি করলে বিক্রিয়াটি পশ্চাৎদিকে আগাবে এবং চাপ হ্রাস করে চাপ বৃদ্ধির ফলাফল প্রশমিত করবে।
আবার সাম্যাবস্থায় চাপ হ্রাস করলে বিক্রিয়াটি সম্মুখদিকে অগ্রসর হবে এবং চাপ বৃদ্ধি করে চাপ হ্রাসের ফলাফল প্রশমিত করবে
বিক্রিয়কের ঘনমাত্রা বাড়ালে → বিক্রিয়াটি সম্মুখদিকে অগ্রসর হবে
উৎপাদের ঘনমাত্রা বাড়ালে → বিক্রিয়াটি পশ্চাৎদিকে অগ্রসর হবে।
যেমন:
N2(g)+3H2(g)⇌2NH3(g)
সাম্যাবস্থায় বিক্রিয়কের ঘনমাত্রা বাড়ালে সাম্যাবস্থা সম্মুখদিকে অগ্রসর হয়ে অ্যামোনিয়ার (NH3) উৎপাদন বৃদ্ধির মাধ্যমে বিক্রিয়কের ঘনমাত্রা বৃদ্ধির ফলাফল প্রশমিত হবে।
বিপরীতে, সাম্যাবস্থায় উৎপাদ (NH3) ঘনমাত্রা বাড়ালে বিক্রিয়াটি পশ্চাৎদিকে আগানোর মাধ্যমে উৎপাদের ঘনমাত্রা বৃদ্ধির ফলাফল প্রশমিত হবে। অর্থাৎ NH3 ভেঙে N2 ও H2 উৎপন্ন হবে।
লা-শাতেলিয়ারের নীতি
লা-শাতেলিয়ারের নীতি অনুসারে, একটি রাসায়নিক সমতলে কোনো পরিবর্তন ঘটালে (যেমন চাপ, তাপমাত্রা বা ঘনমাত্রা পরিবর্তন), সিস্টেম এমন একটি দিকে প্রতিক্রিয়া করে যা সেই পরিবর্তনকে কমাতে কাজ করে।
শিল্পোৎপাদনে প্রয়োগ
১. অ্যামোনিয়া উৎপাদন (হ্যাবার প্রক্রিয়া)
রাসায়নিক বিক্রিয়া:
N2(g) + 3H2(g) → 2NH3(g) + Heat
লা-শাতেলিয়ারের নীতি অনুযায়ী:
• চাপ বৃদ্ধি: চাপ বৃদ্ধি করলে উৎপন্ন গ্যাসের মোল সংখ্যা কমানোর জন্য প্রতিক্রিয় NH3-এর দিকে অগ্রসর হয়।
তাপমাত্রা হ্রাস: তাপমাত্রা কমালে বিক্রিয়া তাপ উৎপন্ন করে ক্ষতিপূরণ করবে, ফল NH3-এর উৎপাদন বাড়বে।
উপযুক্ত অনুঘটক: আয়রন অনুঘটক ব্যবহার করা হয় বিক্রিয়ার হার বৃদ্ধি করতে
২. সালাফডারক অ্যাসিড উৎপাদন (কন্টাক্ট প্রাক্রয়া)
রাসায়নিক বিক্রিয়া:
2SO2(g) + O2(g) + 2SO3(g) + Heat
লা-শাতেলিয়ারের নীতি অনুযায়ী:
চাপ বৃদ্ধি: চাপ বৃদ্ধির ফলে বিক্রিয়া SO₃-এর দিকে অগ্রসর হয়।
তাপমাত্রা হ্রাস: কম তাপমাত্রা উৎপাদন বাড়ায়, তবে খুব কম তাপমাত্রা বিক্রিয়ার হার কমিয়ে দেয়।
ভ্যানাডিয়াম পেন্টাঅক্সাইড (V₂O₃): অনুঘটক হিসাবে ব্যবহৃত হয় বিক্রিয়ার হার বৃদ্ধির জন্য।
৩. মিথানল উৎপাদন
রাসায়নিক বিক্রিয়া:
CO(g) + 2H2(g) → CH3OH(g) + Heat
লা-শাতেলিয়ারের নীতি অনুযায়ী:
৪. ইথাইলিন থেকে পলিথিন উৎপাদন
ইথাইলিনের পলিমারাইজেশনে লা-শাতেলিয়ারের নীতি প্রয়োগ করে:
উপসংহার ব্যতীত রাখা হয়েছে।
ভরক্রিয়া শব্দের আভিধানিক অর্থ ভর দ্বারা সম্পাদিত কাজ। সাধারণ অর্থে ভর যত বেশি হবে সম্পাদিত কাজ তত বেশি হবে। বাংলায় যেমন প্রবাদ আছে “যত গুড় তত মিঠা”। আলোচ্য ক্ষেত্রে কোনো রাসায়নিক বিক্রিয়ার হারের উপর ভরের প্রভাব কিরূপ তার প্রতি ইঙ্গিত দেয়া হয়েছে। সাধারণত কোনো রাসায়নিক বিক্রিয়ায় বিক্রিয়কের ভর যত বেশি হয় বিক্রিয়ার হার তত বেশি হয়। এখানে বিক্রিয়কের ভর বলতে সক্রিয় ভর (active mass) তথা যে ভর বিক্রিয়ায় অংশগ্রহণ করে তাকে বুঝানো হয়েছে। আর সক্রিয় ভরকে কোনো পদার্থের একক আয়তনে বিদ্যমান মোল সংখ্যা দ্বারা প্রকাশ করা যায়।
নরওয়ের অসলো বিশ্ববিদ্যালয়ের দুই জন অধ্যাপক গুলবার্গ এবং পি. ভাগে এই সূত্রটি প্রদান করেন। সূত্রটি হচ্ছে– “নির্দিষ্ট সময়ে নির্দিষ্ট তাপমাত্রায় কোনো রাসায়নিক বিক্রিয়ার হার বিক্রিয়কসমূহের সক্রিয় ভর তথা মোলার ঘনমাত্রা বা আংশিক চাপের সমানুপাতিক।”
মনে করি, A এবং B দু’টি বিক্রিয়ক পরস্পর বিক্রিয়া করে উৎপাদ তৈরি করে।
A+B → উৎপাদ
যদি বিক্রিয়ক A এবং B এর ঘনমাত্রা যথাক্রমে [A] এবং [B] হয়। (ঘনমাত্রাকে সাধারণত [ ] চিহ্ন দ্বারা বুঝানো হয়) তবে ভরক্রিয়া সূত্রানুসারে বিক্রিয়ার হার r ∞ [A] [B]
সমসত্ত্ব সাম্য (Homogeneous Equilibrium) হলো এমন একটি সাম্যাবস্থা যেখানে প্রতিক্রিয়ার সকল উপাদান একই অবস্থায় থাকে, যেমন গ্যাসীয় বা তরল। ভর-ক্রিয়া সূত্র (Law of Mass Action) এই ধরনের সাম্যাবস্থার গাণিতিক ব্যাখ্যা দেয়।
ভর-ক্রিয়া সূত্র অনুযায়ী, একটি রাসায়নিক প্রতিক্রিয়ার হার সংশ্লিষ্ট বিক্রিয়ারকের ঘনত্বের উপর নির্ভর করে। প্রতিক্রিয়ার সাম্য অবস্থায় গঠিত সমীকরণে ঘনত্বের অনুপাত একটি ধ্রুবক মান প্রদান করে, যাকে সাম্য ধ্রুবক (Equilibrium Constant, K ) বলা হয়।
ধরা যাক, একটি সাধারণ প্রতিক্রিয়া:
aA+bBcC + dD
এখানে A এবং B বিক্রিয়ারক, C এবং D পণ্য, এবং a, b, c, d যথাক্রমে স্টইকিওমেট্রিক গুণাঙ্ক।
সাম্য অবস্থায় ভর-ক্রিয়া সূত্রের ব্যবহার করে সাম্য ধ্রুবক K প্রকাশ করা যায়:
K = [C][D]d /[A][B]b
যেখানে [A], [B], [C], এবং [D]হলো সংশ্লিষ্ট উপাদানের সাম্য অবস্থায় ঘনত্ব।
ধরা যাক, একটি গ্যাসীয় প্রতিক্রিয়া:

এখানে:
সমসত্ত্ব সাম্যের ক্ষেত্রে ভর-ক্রিয়া সূত্র সাম্য অবস্থার ঘনত্বের সম্পর্ক নির্ধারণ করতে এবং রাসায়নিক প্রতিক্রিয়ার গতিবিদ্যা বিশ্লেষণে গুরুত্বপূর্ণ ভূমিকা পালন করে। এটি সাম্য ধ্রুবক গণনার মাধ্যমে প্রতিক্রিয়ার গাণিতিক মডেল প্রদান করে।
ধর, তোমার কাছে একটি কন্টেইনারে এক লিটার বিশুদ্ধ পানি আছে। তুমি জানো, পোলার যৌগ হবার কারণে পানি অণুগুলো খানিকটা বিয়োজনপ্রবণ; এর হাইড্রোজন পরমাণু তড়িৎঋণাত্মক অক্সিজেনের কাছে তার ইলেকট্রন হারিয়ে প্রোটন হিসেবে বেরিয়ে যেতে পারে। অম্ল-ক্ষারকের ব্রনস্টেড লাউরির মতবাদ অনুযায়ী এই প্রোটন মুক্ত থাকে না বরং আরেকটি পানির অণুর অক্সিজেন এর সাথে সন্নিবেশ সমযোজী বন্ধন গঠন করে ফেলে। অর্থাৎ এখানে প্রোটন দাতা পানির অণুটির আচরণ অম্লের মত, আর প্রোটনগ্রহীতা অণুটি হল ক্ষারক। 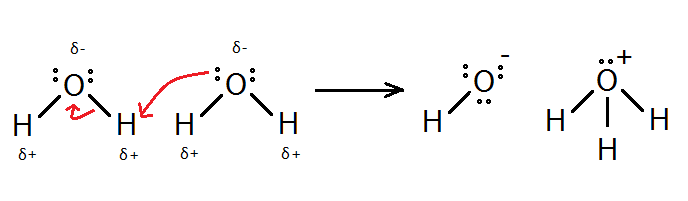
তবে মজার ব্যাপার হল পানি অম্ল বা ক্ষারক – কোনোটি হিসেবেই শক্তিশালী নয়। তাই যদি হয়ে থাকে তবে এখানে অনুবন্ধী অম্ল H3O+ এবং অনুবন্ধী ক্ষারক OH– বেশ শক্তিশালী হবার কথা এবং এরা তৈরি হওয়ামাত্রই বিপরীতমুখী বিক্রিয়া করে পানি বানিয়ে ফেলার কথা। আসলে এমনটাই ঘটে এবং তাই আমাদের বিক্রিয়াটি একমুখী নয়, বরং উভমুখী হিসেবে দেখানো উচিত। 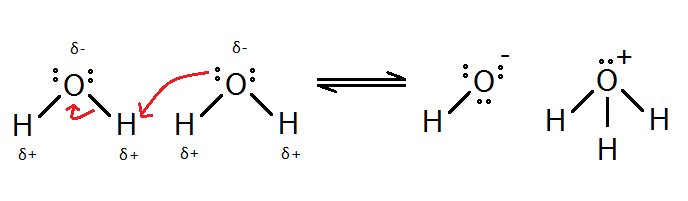
এই উভমুখী বিক্রিয়ার ক্ষেত্রে তাই একটা সাম্যাবস্থা আছে যেখানে দুই ধরণের বিক্রিয়াই একই বেগে চলবে। সাম্যাবস্থা থাকলে সেই সাম্যাবস্থার একটা সাম্য ধ্রুবকও থাকা উচিত। ভরক্রিয়ার সূত্রানুসারে এই সাম্যধ্রুবক K হবে –
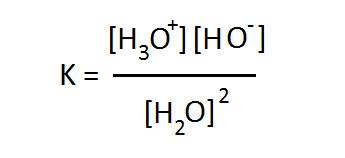
পানির স্ববিয়োজন বিক্রিয়ার সাম্যধ্রুবক বা পানির বিয়োজন ধ্রুবক (Dissociation Constant) এর রাশিমালা
আমরা অনেকেই পানির বিয়োজন এভাবে না লিখে পুরাতন নিয়মে (আরহেনিয়াস মতবাদকে পুঁজি করে) H2O → H+ + OH– লিখে অভ্যস্ত। যেভাবেই লেখা হোক না কেন, বক্তব্য মূলত একই। সরলীকরণের স্বার্থে আমরা এই লেখার বাকী অংশে হাইড্রোনিয়াম আয়নের স্থলে প্রোটন দিয়েই কাজ চালাব। তো ঐ সমীকরণকে আমলে নিলে বিয়োজন ধ্রুবকটি এভাবে লিখতে হয় –
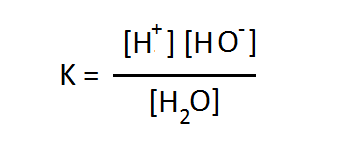
হাইড্রোনিয়াম আয়নের স্থলে প্রোটন লিখে K এর প্রকাশ
এতদূর সব ঠিক আছে। তবে K এর রাশিমালায় একটা জিনিস একটু অপ্রয়োজনীয় আর তা হল পানির ঘনমাত্রা। আগেই বলা হয়েছে, পানি শক্তিশালী এসিড বা ক্ষারক না হওয়ায় এর এরূপ বিয়োজন ঘটে খুব সামান্যই। ২৫ ডিগ্রি সেলসিয়াসে কোনো নির্দিষ্ট মুহূর্তে এক লিটার পানিতে যে পরিমাণ পানির অণু থাকে তাদের প্রতি ৫৫.৫ কোটির মধ্যে কেবল একটি পানির অণুই প্রোটন ত্যাগ করে এভাবে ভেঙ্গে যায়। অতএব যতটুকু পানি আমরা নিয়েছি তার ঘনমাত্রা প্রায় অপরবর্তীত থাকে বলে রায় দেওয়া যায় আর একারণেই [H2O] বলতে নতুন কোনো হিসাব না করে গৃহীত পানির ঘনমাত্রাকেই ধরে নিলে সমস্যা হয় না (প্রসঙ্গত উল্লখ্য, বিশুদ্ধ পানির ঘনমাত্রা 55.5 molL-1; অর্থাৎ প্রতি এক লিটার বিশুদ্ধ পানিতে 1000g বা 55.5 mol পানি থাকে)।
বিয়োজন ধ্রুবক K এর সাথে পানির এই ঘনমাত্রা গুণ করে আমরা পাই নতুন আরেকটি ধ্রুবক Kw , যার নাম পানির আয়নিক গুণফল (Ionic Product of Water) 😀
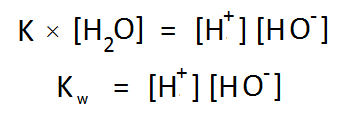
পানির বিয়োজনে প্রাপ্ত আয়নদের ঘনমাত্রার গুণফলের নাম তো “পানির আয়নিক গুণফল”-ই হওয়া উচিত
আমাদের এখন জানার ইচ্ছা হতে পারে, এই Kw এর মান কেমন হয়? এই উত্তর পেতে হলে বুঝতেই পারছ যে সর্বাগ্রে [H+] (আসলে H3O+ এর ঘনমাত্রা) এবং [OH–] এর মান জানা জরুরি। আমরা নিজেরাই বের করতে পারব এদের মান! কীভাবে? দেখ, তোমাকে বলা হয়েছে ২৫ ডিগ্রি সেলসিয়াসে প্রতি ৫৫.৫ কোটি বা 55.5×107 পানি অণুর একটি বিয়োজিত হয়ে একটি প্রোটন তৈরি করে এবং নিজে হাইড্রোক্সিলে পরিণত হয়। আবার আমরা একটু আগে দেখেছি পানির ঘনমাত্রা 55.5 molL-1 । আমরা যদি এক লিটারে থাকা এই 55.5 মোল পানি থেকে কত মোল H+ ও OH– তৈরি হতে পারে তা গণনা করতে পারি তবেই কেল্লা ফতে
ঐকিক নিয়মের আশ্রয় নেওয়া যায় এ ব্যাপারে। আমি এখানে প্রোটন দিয়ে হিসাব করেছি, হাইড্রক্সিলের হিসাবটাও হবে অনুরূপ কারণ পানি বিয়োজিত হয়ে সমপরিমাণ হাইড্রক্সিল ও প্রোটন তৈরি করে। 
অতএব, [H+] = [OH–] = 1×10-7 molL-1
তাই, ২৫ ডিগ্রি সেলসিয়াসে পানির আয়নিক গুণফল Kw = 1×10-14 mol2L-2
Kw এর যে মান আমরা মাত্র পেলাম এটা পড়তে অসুবিধা হয় কেননা এটি দুইটি অংশে বিভক্ত (পূর্ণসংখ্যার সাথে দশভিত্তিক আরেকটি অংশ গুণ আছে)। এমন সংখ্যার চেয়ে আমরা একটা পূর্ণসংখ্যা পড়তেই বেশি স্বচ্ছন্দ। এই উদ্দেশ্যে আমরা Kw এর মানের ঋণাত্মক লগারিদম (দশ ভিত্তিক) নিই যা একটা সুন্দর পূর্ণসংখ্যা উত্তর হিসেবে দেয়। এটাকেই বলা হয় pKw
pKw = -logKw
২৫ ডিগ্রি সেলসিয়াসে Kw এর এককবিহীন মান 1×10-14 হবার কারণে ঐ তাপমাত্রায় এর pKw হয় -log(1×10-14) বা, 14.
অন্যদিকে কোনো দ্রবণে থাকা প্রোটনের ঘনমাত্রার মানের ঋণাত্মক লগারিদম নিলে আমরা যা পাই তা হল pH। বিশুদ্ধ পানি নিরপেক্ষ (না এসিড, না ক্ষারক) কারণ এতে বিয়োজনের ফলে যে পরিমাণ প্রোটন উৎপন্ন হয় (এসিডের মত) ঠিক ততটুকুই হাইড্রোক্সিল আয়ন থাকে (ক্ষারকের ধর্ম)। ২৫ ডিগ্রি সেলসিয়াসে বিশুদ্ধ পানির pH গণনা করে তাই আমরা পাই –
pH = -log[H+] = -log(1×10-7) = 7
বিশুদ্ধ পানিতে এসিড যোগ করলে যেহুতু প্রোটনের ঘনমাত্রা বেড়ে যায় তাই তখন pH এর মান 7 থেকে বিচ্যুত হয়। উদাহরণস্বরূপ, প্রোটনের ঘনমাত্রা 1×10-7 molL-1 এর দশগুণ (1×10-6 molL-1) হলে pH হয় -log(1×10-6) = 6। সুতরাং অম্লীয় দ্রবণের pH 7 এর কম হয়। একইভাবে, ক্ষারক যোগ করলে [H+] এর মান হ্রাস পায় এবং pH 7 এর চেয়ে বেড়ে যায়।
প্রশ্ন হতে পারে, আমরা কেন এটাকে কেবল pH ই বলছি cH, mH ইত্যাদি কেন নয়। p বর্ণটি ব্যবহার করা হয় জার্মান শব্দ potenz এর অদ্যাক্ষর হিসেবে, যার অর্থ power বা শক্তি।
pH এর মত একইভাবে pOH নির্ণয় করা যায় দ্রবণের হাইড্রোক্সিল আয়নের ঘনমাত্রার মানের ঋণাত্মক লগারিদম নিলে। মজার ব্যাপার হল pH এবং pOH এর যোগফল সর্বদা pKw এর সমান হয়। এই প্রমাণটা তোমরা নিজেরাই করে দেখতে পারো। ২৫ ডিগ্রি সেলসিয়াসে পানির pOH তাই হাইড্রোক্সিল আয়নের ঘনমাত্রা থেকে সরাসরি বের করতে পারো অথবা pKw থেকে pH বাদ দিয়েও নির্ণয় করতে পারো। উভয়ক্ষেত্রেই উত্তর আসবে 7.
আমাদের একটা কমন মাইন্ডসেট হল বিশুদ্ধ পানি বলতেই pH বুঝি 7 বোঝায়। কিন্তু কথাটা কেবল মাত্র ২৫ ডিগ্রি সেলসিয়াস তাপমাত্রার পানির জন্য সত্য।
পানির বিয়োজন বিক্রিয়াটি একটি তাপহারী বিক্রিয়া। তাই তাপমাত্রা বাড়লে লা শাঁতেলিয়ার নীতি অনুযায়ী পানির ভাঙ্গন (সম্মুখমুখী বিক্রিয়া) ত্বরান্বিত হয় এবং অধিক পরিমাণ প্রোটন ও হাইড্রক্সিল আয়ন তৈরি হয়। স্বভাবতই এজন্য পানির আয়নিক গুণফল যায় বেড়ে। এই যেমন ৪০ ডিগ্রি সেলসিয়াসে Kw এর মান বেড়ে হয়ে যায় 2.916×10-14 mol2L-2
অর্থাৎ, [H+] × [OH–] = 2.916×10-14 mol2L-2
[H+]2 = 2.916×10-14 mol2L-2 (যেহেতু, [H+] = [OH–])
বা, [H+] = 1.482×10-7 molL-1
সুতরাং, pH = -log(1.482×10-7 ) = 6.77
যদি জিজ্ঞাস করি, এই ৪০ ডিগ্রি সেলসিয়াস তাপমাত্রায় পানির pOH কত হবে তখন ভুলেও 14 থেকে 6.77 বিয়োগ করে উত্তর বলা যাবে না। কারণ এই তাপমাত্রায় pKw তো আর 14 নয়, সেটারও পরিবর্তন ঘটেছে। আমি যে Kw ব্যবহার করেছি তা থেকে pKw নির্ণয় করতে হবে নতুন করে। দেখবে, এখানে pOH সেই 6.77 ই আসবে। তাই তোমাকে এটা বুঝতে হবে যে, তাপমাত্রা বাড়লে পানি অম্লীয় হয়ে গেল – এমনটা নয়। H+ বেশি তৈরি হয় ঐ তাপমাত্রায় তাই pH হয় কম, কিন্তু একসাথেই সমপরিমাণ OH–ও তৈরি হয় যা পানিকে নিরপেক্ষই রাখে। অন্যদিকে নিম্ন তাপমাত্রায় পানির আয়নিক গুণফল কমে যায় এবং ফলশ্রুতিতে pH বেড়ে যায়।
উইলহেল্ম অসওয়াল্ডের লঘুকরণ সূত্র ১৮৮৮ সালে দুর্বল তড়িৎ বিশ্লেষ্যের জন্য বিয়োজন ধ্রুবক Kd এবং বিয়োজন মাত্রা α এর মধ্যে প্রস্তাবিত একটি সম্পর্ক। সূত্রটির সাধারণ রূপ হলো:

লঘুকরণ
যেখানে বর্গাকার বন্ধনীগুলি ঘনত্বকে নির্দেশ করে এবং c0 তড়িৎ বিশ্লেষ্যের মোট ঘনত্ব।

ফ্রিডরিখ ভিলহেল্ম অস্টভাল্ড



একটি দ্বি-মৌলবিশিষ্ট তড়িৎ-বিশ্লেষ্য AB বিবেচনা করুন যা বিপরীতভাবে A + এবং B - আয়নদ্বয়ে বিয়োজিত হয়।অসওয়াল্ড উল্লেখ করেছেন যে ভরক্রিয়ার সূত্র তড়িৎ বিশ্লেষ্য সিস্টেমগুলিতে প্রয়োগ করা যেতে পারে। সাম্যাবস্থায় এটিকে নিম্নোক্ত সমীকরণ দ্বারা প্রতিনিধিত্ব করা হয়:
যদি α বিয়োজিত তড়িৎ বিশ্লেষ্যের ভগ্নাংশ হয়, তবে αc0 প্রতিটি আয়নের ঘনত্ব হবে। (1 - α) অবশ্যই অবিয়োজিত তড়িৎ বিশ্লেষ্যের পরিমাণ এবং (1 - α) c0 এর ঘনত্ব হতে হবে।বিয়োজন ধ্রুবক হিসাবে লেখা যেতে পারে:
খুব দুর্বল তড়িৎ-বিশ্লেষ্যের জন্য (তবে, বেশিরভাগক্ষেত্রে দুর্বল তড়িৎ বিশ্লেষ্যের জন্য 'α' উপেক্ষা করলে ভালো ফলাফল দেয়), α<< 1 বোঝাচ্ছে যে (1 - α) ≈ 1 ব্যবহার করা যাবে ।
এটি নিম্নলিখিত ফলাফল দেয়;
এইভাবে, একটি দুর্বল তড়িৎ-বিশ্লেষ্যের জন্য বিয়োজন মাত্রা ঘনমাত্রার বর্গমূলের ব্যস্তানুপাতিক বা আয়তনের বর্গমূলের সমানুপাতিক।যেকোন একটি আয়নের ঘনত্ব বিয়োজন ধ্রুবক এবং তড়িৎ বিশ্লেষ্যের ঘনত্বের গুণফল দ্বারা নির্ণয় করা হয়।
অসওয়াল্ডের লঘুকরণ সূত্র মূলত CH3COOH এবং NH4OH মত বিভিন্ন দুর্বল তড়িৎ-বিশ্লেষ্য পরিবাহির ঘনমাত্রা নির্ণয়ের জন্য সন্তোষজনক বর্ণনা প্রদান করে। মোলার পরিবাহিতার তারতম্য মূলত দুর্বল তড়িৎ-বিশ্লেষ্যের বিয়োজনের কারণে বিভিন্ন হয়ে থাকে।
একটি নির্দিষ্ট তাপমাত্রায় প্রতি লিটার জলীয় দ্রবণে উপস্থিত কোনো অম্লের সংখ্যার যে ভগ্নাংশ বিয়োজিত থাকে, তাকে ঐ অম্লের বিয়োজন ধ্রুবক বলা হয়।
মনে করি, একটি এসিড জলীয় দ্রবণে নিম্নরূপে আয়নিত অবস্থায় আছে।
HB+H2O⇌H3O++B−Ka=[HB][H2O][H3O+][B−]=[HB][H3O+][B−]
[এর মান পানির ঘনমাত্রার উপর নির্ভরশীল নয়।]
এসিড জলীয় দ্রবণে H+ দান করে অর্থাৎ, [H3O+] উৎপন্ন করে। এখানে, Ka হলো এসিড বিয়োজন ধ্রুবক এর একক হলো molL−1 । এর মান অধিক হলে ঐ এসিড এর শক্তিমাত্রা বেশি হয়।
একটি নির্দিষ্ট তাপমাত্রায় প্রতি লিটার জলীয় দ্রবণে উপস্থিত কোনো ক্ষারকের মোল সংখ্যার যে ভগ্নাংশ বিয়োজিত অবস্থায় থাকে, তাকে ঐ ক্ষারকের বিয়োজন ধ্রুবক বলে।
B−+H2O⇌HB+OH−
ক্ষারক
Kb=[B−][H2O][HB][OH−]=[B−][HB][OH−]
এখানে, kb হলো ক্ষারুকের বিয়োজন ধ্রুবক। এর মান বৃদ্ধি পেলে ক্ষারকের শক্তিমাত্রা বৃদ্ধি পায়। এর একক হলো molL−1
দুর্বল অ্যাসিড এবং বেস এর ionization বিপরীতমুখী হয়
দুর্বল অ্যাসিড, সংক্ষেপে HA হিসাবে, জলে হাইড্রোজেন (বা প্রোটন) দান করে, A– এবং H3O+ গঠন করে, যা নীচে দেখানো হয়েছে:
HA(aq) + H2O(l) ⇌ H3O+(aq) + A–(aq)
একইভাবে, পানিতে, একটি বেস (সংক্ষেপে B হিসাবে) একটি প্রোটন গ্রহণ করে কনজুগেট অ্যাসিড, HB+ এবং OH–, যেমন দেখানো হয়েছে:
B(aq) + H2O(l) ⇌ HB+(aq) + OH–(aq)
আয়নকরণ প্রতিক্রিয়ার ভারসাম্য ধ্রুবক দুর্বল অ্যাসিড বা বেস দেওয়া প্রতিটি প্রজাতির আপেক্ষিক পরিমাণের পরিমাণ নির্ধারণ করে। একটি কনজুগেট অ্যাসিড-বেস জোড়ার জন্য ভারসাম্য ধ্রুবক Ka এবং Kb-এর মধ্যে সম্পর্ক এই নিবন্ধে আলোচনা করা হবে।
দ্রষ্টব্য: এই নিবন্ধের উদ্দেশ্যে সমস্ত সমাধানকে জলীয় সমাধান বলে ধরে নেওয়া হবে।
For HA Reacting As An Acid, We Need To Find Ka
Taking a close look at the dissociation reaction for a monoprotic weak acid HA:
A-, HA এর সংযোজিত ভিত্তি এবং H3O+ এই বিপরীত প্রতিক্রিয়ার ফলাফল। ভারসাম্য ধ্রুবক Ka এর জন্য, আমরা নিম্নলিখিত রাশিটি তৈরি করতে পারি:
রসায়নে Ka কি?
A-এর জন্য Kb খোঁজা- একটি ভিত্তি হিসাবে প্রতিক্রিয়া করা
আমরা বিকল্পভাবে পানি থেকে প্রোটন গ্রহণ করে A– একটি বেস হিসাবে কাজ করার জন্য বিপরীত প্রক্রিয়া প্রকাশ করতে পারি কারণ A– একটি বেস:
HA এবং OH- এই বিক্রিয়ার শেষ পণ্য। বিক্রিয়ার জন্য ভারসাম্য ধ্রুবক Kb যেখানে বেস হিসাবে A– ফাংশনগুলি নিম্নরূপ লেখা যেতে পারে:
যদিও এটি একটি অ্যাসিড হিসাবে কাজ করে HA এর বিপরীত বলে মনে হয়, দুটি প্রতিক্রিয়া বেশ স্বতন্ত্র। H3O+ হল একটি অ্যাসিড হিসাবে পরিবেশন করা HA এর ফলাফলগুলির মধ্যে একটি। একটি সংযুক্ত বেস A- বেস হিসাবে কাজ করে OH–।
আরও পড়ুন:
Kb সূত্র কি?
কনজুগেট অ্যাসিড-বেস পেয়ারের জন্য Ka এবং Kb-এর মধ্যে সম্পর্ক
যখন HA-এর জন্য Ka কে এর সংযোজিত ভিত্তি A- এর Kb দ্বারা গুণ করা হয়, তখন আমরা পাই:
যেখানে Kw হল জল বিয়োজন ধ্রুবক।
Kw কি?
Kw হল বিপরীতমুখী প্রক্রিয়ার জন্য ভারসাম্য ধ্রুবক যা দুটি জলের অণু থেকে H3O+ এবং OH– তৈরি করে।
H2O(l) + H2O(l) ⇌ H3O+(aq) + OH–(aq)
Ka এবং Kb সম্পর্কিত প্রায়শ জিজ্ঞাস্য প্রশ্নাবলী
Ka এবং Kb মধ্যে সম্পর্ক কি?
অ্যাসিড বিয়োজন ধ্রুবক হল Ka. ভিত্তি যত শক্তিশালী, Kb-এর মান তত বেশি এবং অ্যাসিড যত শক্তিশালী, Ka-এর মান তত বেশি। যখন আমরা Ka কে Kb দ্বারা গুণ করি, তখন আমরা পাই Kw, বা জল বিভাজন ধ্রুবক, যা 1.0 x 10-14।
Ka এবং Kb মধ্যে কোন পার্থক্য আছে?
অ্যাসিড বিয়োজন ধ্রুবক (Ka) হল দ্রবণে অ্যাসিডের শক্তির একটি সংখ্যাগত পরিমাপ, যেখানে বেস ডিসোসিয়েশন ধ্রুবক (Kb) মৌলিকতা বা সাধারণভাবে বেসের শক্তি পরিমাপ করে। জলে তাদের আয়নকরণের উপর ভিত্তি করে, অ্যাসিডগুলিকে শক্তিশালী বা দুর্বল হিসাবে শ্রেণীবদ্ধ করা হয়।
Ka এবং Kb পরিমাপের একক কী?
একটি অ্যাসিড বা মৌলিক কতটা ভালভাবে বিচ্ছিন্ন হয় তা নির্ধারণ করতে আমরা বিয়োজন ধ্রুবক ব্যবহার করি। এই মানগুলিকে এসিডের ক্ষেত্রে Ka দ্বারা এবং ঘাঁটির ক্ষেত্রে Kb দ্বারা চিহ্নিত করা হয়। এই ধ্রুবকগুলির জন্য কোন ইউনিট বরাদ্দ করা হয় না।
জলের স্বয়ংক্রিয়করণ বলতে কী বোঝ?
হাইড্রোনিয়াম আয়ন (H3O+) এবং হাইড্রোক্সাইড আয়ন (OH–) দুটি আয়ন তৈরি করতে জলের অণুগুলির প্রক্রিয়াটি জলের অটোআয়নাইজেশন হিসাবে পরিচিত।
কিভাবে আপনি অ্যাসিড এবং ঘাঁটি মধ্যে পার্থক্য বলতে পারেন?
প্রতিক্রিয়ার আগে এবং পরে প্রতিটি উপাদানের হাইড্রোজেনগুলি গণনা করুন এটি একটি অ্যাসিড বা মৌলিক কিনা তা দেখতে। সেই পদার্থটি হল অ্যাসিড যদি এতে হাইড্রোজেনের পরিমাণ কমে যায় (দান করা হাইড্রোজেন আয়ন)। যদি কোনো পদার্থে হাইড্রোজেনের পরিমাণ বেড়ে যায়, তাহলে সেটি হল ভিত্তি (হাইড্রোজেন আয়ন গ্রহণ করে)s).

অনুবন্ধী অম্ল এবং ক্ষারকের ক্ষেত্রে তাদের অম্লত্ব ধ্রুবক (Ka) এবং ক্ষারত্ব ধ্রুবক (Kb) এর মধ্যে একটি সরাসরি সম্পর্ক বিদ্যমান। এ সম্পর্কটি জলীয় দ্রবণে অম্ল-ক্ষার সমীকরণের মাধ্যমে সহজেই বোঝা যায়।
অম্লের জন্য, Ka (অম্লত্ব ধ্রুবক) হচ্ছে দ্রবণে H⁺ আয়নের একগামিতা পরিমাপ।
Ka = [H+][A-] /[HA]
জলীয় মাধ্যমের জন্য সম্পর্ক:
জলের আয়নিক ধ্রুবক K এর মান, যা H আয়নের ঘনমাত্রার গুণফল, সবসময় ধ্রুবক Kw = [H+][OH-] = 10-14 (25°C তা অনুবন্ধী অম্ল ও ক্ষারকের Ka ও Kb এর মধে Ka x Kb = Kw
যেখানে,
এই সম্পর্কটি ব্রনস্টেড-লোরি তত্ত্বের মাধ্যমে সহজেই প্রমাণিত হয় এবং এটি অম্ল-ক্ষার প্রক্রিয়াগুলি বুঝতে খুবই গুরুত্বপূর্ণ।
কোনো ক্ষারকের এসিড নিরপেক্ষ করার ক্ষমতাকে ঐ ক্ষারকের অম্লত্ব বলা হয়। কোনো ক্ষারকের 1 mol মনোপ্রোটিক (HCl) এসিডের যত মোলকে সম্পূর্ণরূপে প্রশমিত করতে পারে সে সংখ্যা দ্বারা অম্লত্ব নির্ধারণ করা হয়। যেমন- Ca(OH)2 এর অম্লত্ব 2; CaO এর অম্লত্ব 2
কোনো অম্লের ক্ষারক নিরপেক্ষ করার ক্ষমতাকে ঐ অম্লের ক্ষরকত্ব বলে। কোনো অম্লের 1 মোল মনোপ্রোটিক ক্ষারের ( একটি H+ গহণ করতে পারে) যত mol কে সম্পূর্ণরূপে প্রশমিত করতে পারে সে সংখ্যা দ্বারা ক্ষারকত্ব নির্ণয় করা হয়। H2SO4 একটি দ্বিক্ষারীয় এসিড।
2NaOH+H2SO4→Na2SO4+2H2O
pH স্কেল হল আসলে একটি পরিমাপ ব্যবস্থা।এই ব্যবস্থার মাধ্যমে কোন দ্রবণ কতটা আম্লিক বা কতটা ক্ষারকীয় বা প্রশম তা পরিমাপ করা যায়।
pH স্কেলে সর্বনিম্ন 0 থেকে সর্বোচ্চ 14 পর্যন্ত রেখাঙ্কিত থাকে। প্রশমন দ্রবণ এর pH এর মান 7 এর কম এবং ক্ষারকীয় দ্রবণের pH এর মান 7 এর বেশি হয়। তীব্র ক্ষারের pH এর মান 11 এর বেশি এবং তীব্র অ্যাসিডের pH এর মান 3 এর কম হয়।
যদি দুটি দ্রবণের ই pH এর মান 7 এর কম হয় তাহলে বুঝতে হবে যে দুটি দ্রবণই আম্লীক প্রকৃতির এবং যে দ্রবণটির pH এর মান যত তুলনামূলকভাবে কম সেটি তুলনামূলকভাবে বেশি আম্লীক প্রকৃতির।
যে দ্রবণের সামান্য পরিমাণ সরল এসিড বা ক্ষারক যোগ করার পরেও দ্রবণের pH মান প্রায় অপরিবর্তিত থাকে তাকে বাফার দ্রবণ বলে। কোনো দ্রবণের pH পরিবর্তনের প্রতিরোধ করার ক্ষমতা সে দ্রবণের বাফার ক্ষমতা বলে এবং এক্ষেত্রে দ্রবণটি যে কৌশল অবলম্বন করে তা বাফার কৌশল বা বাফার ক্রিয়া বলে। এটি দুই ধরনের হয়।
১। অম্লীয় প্রকৃতির বাফার দ্রবণ (Buffer solution of acidic nature): এটি একটি দুর্বল এসিড এবং ঐ এসিডের সবল ক্ষারের সময়ে লবণের নির্দিষ্ট অনুপাতে তৈরি করা। যেমন-
CH3COOH+CH3COONa ও H2CO3+NaHCO3,HCN+NaCN
২। ক্ষারীয় প্রকৃতির বাফার দ্রবণ (Buffer solution of alkaline nature): এটি কোনো দুর্বল ক্ষারক এবং এর সবল এসিডের সমন্বয়ে গঠিত লবণের নির্দিষ্ট অনুপাতে তৈরি হয়।
NH4OH+NH4Cl
অম্লীয় প্রকৃতির স্কোর দ্রবণ । যেমন- CH3COOH এবং CH3COONa মিশ্রণে এসিড এবং লবণ নিম্নরূপে আয়নিত অবস্থায় থাকে
CH3COOH⇌CH3COO−+H+ CH3COONa→CH3COO−+Na+
এ বাফার দ্রবণে CH3COO− এর ঘনমাত্রা CH3COONa এর ঘনমাত্রার প্রায় সমান। কারণ CH3COOH দুর্বল এসিড তাছাড়া সমআয়ন প্রভাবের কারণেও এর বিয়োজন হ্রাস পায়।
বহিরাগত H+ আয়নের অপসারণ (Removal of H+ ions):
যদি সামান্য পরিমাণ এসিড অর্থাৎ H+ এই বাফার দ্রবণে যোগ করা হয়। তখন তা দ্রবণে বিদ্যমান CH3COO−এর সাথে বিক্রিয়া করে দুর্বল এসিড CH3COOH এ পরিণত হয়। যেহেতু এটি একটি দুর্বল এসিড তাই এর বিয়োজনের পরিমাণ খুবই কম হয়। তাছাড়া সমআয়ন CH3COO− প্রভাবের কারণেও এর বিয়োজন এতই হ্রাস পায় যে, তা থেকে উৎপন্ন H+ আয়ন দ্রবণের pH মানের তেমন কোনো পরিবর্তন করতে পারে না।
অর্থাৎ প্রায় অপরিবর্তিত থাকে।
CH3COO−+H+⇌CH3COOH
বা, CH3COONa+HCl→CH3COOH+NaCl
CH3COOH⇌CH3COO−+H+
বহিরাগত OH− আয়নের অপসারণ (Removal of OH− ion)::
বাফার দ্রবণে সামান্য পরিমাণ ক্ষার অর্থাৎ OH− আয়ন যোগ করা হলে তা বাফার দ্রবণে বিদ্যমান H+ এর সাথে বিক্রিয়া করে H2O উৎপন করে । H2O একটি মৃদু তড়িৎ বিশ্লেষ্য হওয়ার কারণে তা দ্রবণের pH মানের তেমন কোনো পরিবর্তন করতে পারে না। তাছাড়া এই বিক্রিয়ার ফলে দ্রবণে H+ এর ঘাটতি হতে পারে কিন্তু অবিয়োজিত ইথানয়িক এসিড বিয়োজিত হয়ে H+ আয়ন তৈরি করে বিক্রিয়ারত H+ আয়নের অভাব পূরণ করে।
H++OH−⟶H2O
বা, CH3COOH+NaOH→CH3COONa+H2O
CH3COO−+H+⟶CH3COOH
অতএব, দেখা যায় যে, বাফার দ্রবণে সামান্য পরিমাণ এসিড বা ক্ষার যোগ করা হলে তাই বাফার দ্রবণের উপাদানের সাথে আন্তঃক্রিয়ার করলে অপসারিত হয়। ফলে pH মান প্রায় অপরিবর্তিত থাকে।
ক্ষারীয় প্রকৃতির বাফার দ্রবণের ক্রিয়াকৌশল (Mechanism of buffer solution of alkaline nature):
ক্ষারীয় প্রকৃতির বাফার দ্রবণে ক্ষার এবং লবণ নিম্নরূপে আয়নিত থাকে। যেমন-
NH4OH⇌NH4++OH−
HCl+NH4OH→NH4Cl+H2O [এক্ষেত্রে NH4+ এর ঘনমাত্রা NH4CI এর ঘনমাত্রার প্রায় সমান)।
NH4OH একটি দুর্বল ক্ষারক এবং সমআয়ন প্রভাবের কারণে NH4OH এর বিয়োজন খুবই হ্রাস পায়।
বহিরাগত H+ এর অপসারণ (Removal of H+ ion):
এই বাফার দ্রবণে সামান্য পরিমাণ এসিড তথা H+ আমন যোগ করা হলে তা বাফার দ্রবণের OH− এর সাথে বিক্রিয়া করে খুবই দুর্বল তড়িৎ বিশ্লেষ্য তথা নিরপেক্ষ যৌগ পানিতে পরিণত হয়। এর ফলে PH মান প্রায় অপরিবর্তিত থাকে।
H++HO−⟶H2O
বা, HCl+NH4OH⟶NH4Cl+H2O
এই বিক্রিয়ার ফলে দ্রবণে যে OH− আয়নের অভাব তৈরি হয় তা অবিয়োজিত NH4OH এর বিয়োজনের মাধ্যমে পূরণ হয়।
NH4OH⇌NH4++OH−
বহিরাগতOH−এর অপসারণ (Removal of OH− ion):
এই বাফার দ্রবণে সামান্য পরিমাণ ক্ষার বাOH− আয়ন যোগ করা হলে তা বাফার দ্রবণের NH4+ এর সাথে বিক্রিয়া করে NH4OH এ পরিনত হয়। যা একটি দুর্বল তড়িৎ বিশ্লেষ্য। তাছাড়া সমআয়ন প্রভাবের কারণেও NH4OH এর বিয়োজিত হবার প্রবণতা হ্রাস পায়। তাই দ্রবণের pH মান প্রায় অপরিবর্তিত।
NH4++OH−⇌NH4OH বা, NH4Cl+NaOH→NH4OH+NaCl
অর্থাৎ উপরোক্ত কারণে দ্রবণের pH মান প্রায় অপরিবর্তিত থাকে।
মানবদেহের রক্তের pH মান 7.4। অর্থাৎ সামান্য ক্ষারীয় প্রকতির। তবে রক্তের pH মান কোনো কারণে 0.5 এর বেশি পরিবর্তিত হলে জীবন সংকটাপন্ন হয়। রক্তের PO43−,HCO3− প্রোটিন বাফার ক্রিয়ায় অংশগ্রহণ করে। এক্ষেত্রে HCO3− এবং H2CO3 এ কৌশল বর্ণনা করা হয়।
১। H+ এর অপসারণ: (Removal of H+) : অম্ল জাতীয় যৌগ বা পদার্থ রক্তে শোষিত হলে অম্লের H+ নিম্নরূপে প্রশমিত হয়-
H++HCO3−→H2CO3
উৎপন্ন H2CO3 দুর্বল হওয়ায় তা বিয়োজিত হয়ে পানি এবং CO2–এ পরিণত হয়।
২। OH− এর অপসারণ (Removal of OH−): রক্তে ক্ষার জাতীয় দ্রবণ যোগ করা হলে তা নিম্নরূপে বিক্রিয়ার মাধ্যমে প্রশমিত হয়-
H2CO3+OH−⟶HCO3−+H2O
এভাবেই বাই কার্বনেট- কার্বনিক এসিড রক্তের pH মানের পরিবর্তন হতে দেয় না।
অম্লধর্মী মাটির pH বাড়াতে চুন এবং Ca ও Mg এর বিভিন্ন সার ব্যবহৃত হয়। অপরদিকে ক্ষারকীয় মাটির pH কমানোর জন্য বিভিন্ন নাইট্রেট সার যেমন- KNO3,(NH4)2NO3 এবং ফসফেট সার যেমন- TSP ব্যবহৃত হয়। মানুষের চামড়ার pH 4.5-6 তাই প্রসাধনী সামগ্রীর pH 5.5 এর কাছাকাছি হয়।
pH হলো একটি স্কেল যা দ্রবণের অম্লতা বা ক্ষারত্ব প্রকাশ করে। এটি ০ থেকে ১৪ এর মধ্যে মান গ্রহণ করে, যেখানে ৭ নিরপেক্ষ, এর চেয়ে কম মান অম্লধর্মী এবং এর চেয়ে বেশি মান ক্ষারধর্মী। pH এর এই স্কেল রসায়ন শিল্পে বিভিন্ন প্রয়োগে অত্যন্ত গুরুত্বপূর্ণ।
বিভিন্ন রাসায়নিক উৎপাদনে সঠিক pH বজায় রাখা অত্যন্ত গুরুত্বপূর্ণ। যেমন, সার উৎপাদন, কাগজ শিল্প, এবং প্লাস্টিক প্রস্তুতিতে pH এর সঠিক নিয়ন্ত্রণ প্রয়োজন হয়।
খাদ্য সংরক্ষণ ও প্রক্রিয়াকরণে pH একটি গুরুত্বপূর্ণ ভূমিকা পালন করে। খাদ্যের স্বাদ, গুণমান, এবং সংরক্ষণ ক্ষমতা নির্ভর করে দ্রবণের pH মানের ওপর।
পানির মান উন্নত করার জন্য pH নিয়ন্ত্রণ আবশ্যক। পানিকে পানযোগ্য করতে এবং দূষণ প্রতিরোধে সঠিক pH মান বজায় রাখা হয়।
ওষুধ প্রস্তুতিতে pH অত্যন্ত গুরুত্বপূর্ণ। সঠিক pH মান বজায় রাখার মাধ্যমে ওষুধের কার্যকারিতা এবং সংরক্ষণ ক্ষমতা নিশ্চিত করা হয়।
ধাতুকে ক্ষয় থেকে রক্ষা করার জন্য বিভিন্ন রাসায়নিক প্রক্রিয়ায় pH নিয়ন্ত্রণ করা হয়। বিশেষত, ইলেক্ট্রোপ্লেটিং এবং ধাতব পৃষ্ঠ পরিষ্কারে সঠিক pH মান প্রয়োজন।
pH এর সঠিক ব্যবস্থাপনা রসায়ন শিল্পের বিভিন্ন ক্ষেত্রে অপরিহার্য। এটি কেবল উৎপাদনের গুণমান নিশ্চিত করে না, পরিবেশ রক্ষায়ও গুরুত্বপূর্ণ ভূমিকা পালন করে।
টয়লেট্রিজ পণ্য যেমন সাবান, শ্যাম্পু, লোশন, এবং অন্যান্য প্রসাধনীতে pH একটি গুরুত্বপূর্ণ ভূমিকা পালন করে। pH একটি রাসায়নিক পরিমাপ যা কোনো দ্রবণের অ্যাসিডিক বা ক্ষারীয় প্রকৃতি নির্দেশ করে। টয়লেট্রিজ পণ্যগুলির কার্যকারিতা, ত্বকের সাথে সামঞ্জস্যতা এবং স্থায়িত্ব অনেকাংশে pH এর উপর নির্ভর করে।
pH হলো একটি স্কেল যা ০ থেকে ১৪ পর্যন্ত বিস্তৃত।
টয়লেট্রিজ পণ্য তৈরির ক্ষেত্রে pH নির্ধারণে একটি pH মিটার বা লিটমাস পেপার ব্যবহার করা হয়।
মানব ত্বকের সাধারণ pH হলো ৪.৫ থেকে ৫.৫। এই pH স্তর ত্বকের সুরক্ষা বাধা (acid mantle) বজায় রাখতে সহায়তা করে।
pH পণ্যের কার্যকারিতায় প্রভাব ফেলে। উদাহরণস্বরূপ:
সঠিক pH বজায় রাখার মাধ্যমে টয়লেট্রিজ পণ্যের রাসায়নিক স্থায়িত্ব নিশ্চিত করা যায়।
pH পরিবেশে পণ্যের প্রভাবকেও নির্ধারণ করে।
ঔষধ সেবনে pH এর গুরুত্ব প্রধানত এর দ্রবণীয়তা, শোষণ ক্ষমতা, এবং কার্যকারিতা নিশ্চিত করার জন্য গুরুত্বপূর্ণ। শরীরে ঔষধের সঠিক কার্যকারিতা নির্ভর করে তা সঠিকভাবে দ্রবীভূত এবং শোষিত হওয়ার উপর। pH মান বিভিন্ন অঙ্গের পরিবেশে ভিন্ন হয়, যেমন পাকস্থলীতে এটি সাধারণত ১.৫-৩.৫, যেখানে অন্ত্রে এটি ৬-৭.৫। এই পরিবেশে ঔষধের দ্রবণীয়তা এবং শোষণ ভিন্ন ভিন্ন রূপ নেয়।
এই কারণগুলোর ভিত্তিতে ঔষধ প্রস্তুতকারকরা pH এর গুরুত্ব বিবেচনা করে ফর্মুলেশন তৈরি করেন, যাতে তা সঠিক পরিবেশে কার্যকর হতে পারে এবং পার্শ্বপ্রতিক্রিয়া কম হয়।
পিএইচ (pH) পরিমাপ প্রসাধন সামগ্রী নির্বাচন করার একটি গুরুত্বপূর্ণ ধাপ, কারণ এটি ত্বকের সুস্থতা বজায় রাখতে সহায়ক। প্রসাধন সামগ্রী নির্বাচনের সময় পিএইচ বিবেচনা করলে ত্বকের প্রাকৃতিক ব্যারিয়ার রক্ষা করা যায় এবং বিভিন্ন সমস্যা যেমন শুষ্কতা, অ্যালার্জি, বা অতিরিক্ত তৈলাক্ত ভাব এড়ানো যায়।
এভাবে ত্বকের পিএইচ বজায় রেখে প্রসাধন সামগ্রী নির্বাচন করলে ত্বকের দীর্ঘস্থায়ী সুস্থতা নিশ্চিত করা সম্ভব।
ভর শক্তির নিত্যতা সূত্রটি পদার্থবিজ্ঞানের একটি মৌলিক নীতি, যা বলে যে কোনো বন্ধ সিস্টেমে ভর এবং শক্তি নিত্য থাকে। এটি প্রকৃতির একটি প্রাথমিক আইন এবং পদার্থবিজ্ঞানের বিভিন্ন শাখায় প্রয়োগ করা হয়। সূত্রটি আলবার্ট আইনস্টাইনের বিখ্যাত সমীকরণ E=mc^2-এর মাধ্যমে প্রমাণিত, যা ভর এবং শক্তির মধ্যে সম্পর্ক নির্ধারণ করে।
এই সূত্রটি অনুসারে, কোনো সিস্টেমে ভর বা শক্তি সৃষ্টি বা ধ্বংস হয় না। তবে, ভর শক্তিতে এবং শক্তি ভরে রূপান্তরিত হতে পারে। উদাহরণস্বরূপ, একটি নিউক্লিয়ার বিক্রিয়ায় ভরের কিছু অংশ শক্তিতে পরিণত হয়।
ভর শক্তির নিত্যতা সূত্রকে গাণিতিকভাবে প্রকাশ করা যায় এভাবে:
E = mc^2
এখানে,
এই সমীকরণ অনুযায়ী, ভরের একটি ক্ষুদ্র পরিমাণও বিপুল পরিমাণ শক্তি উৎপন্ন করতে পারে।
১. নিউক্লিয়ার ফিউশন: সূর্যের কেন্দ্রস্থলে হাইড্রোজেন পরমাণু হিলিয়ামে রূপান্তরিত হয়, যেখানে ভরের ক্ষতি শক্তি হিসেবে নির্গত হয়।
২. নিউক্লিয়ার ফিশন: পারমাণবিক চুল্লিতে ভারী পরমাণু বিভক্ত হয়ে শক্তি উৎপন্ন করে, যা বিদ্যুৎ উৎপাদনে ব্যবহৃত হয়।
১. জ্বালানি উৎপাদন: পারমাণবিক শক্তি উৎপাদনে ভর শক্তির নিত্যতা সূত্র প্রয়োগ করা হয়।
২. বিজ্ঞানের গবেষণা: মহাবিশ্বের উৎপত্তি এবং এর প্রকৃতি বোঝার জন্য এই সূত্রটি গুরুত্বপূর্ণ।
১. বিক্রিয়ার এনথালপি পরিবর্তন
রসায়নীয় বিক্রিয়ার সময় তাপের যে পরিবর্তন ঘটে, তাকে বিক্রিয়ার এনথালপি পরিবর্তন বলে। এটি সাধারণত বিক্রিয়া শোষণকারী বা নির্গতকারী তাপের মাধ্যমে পরিমাপ করা হয়।
২. গঠনের এনথালপি পরিবর্তন
যখন একটি যৌগ তার উপাদান মৌলসমূহ থেকে গঠিত হয়, তখন নির্গত বা শোষিত তাপকে গঠনের এনথালপি বলে। এটি সাধারণত স্ট্যান্ডার্ড অবস্থা অনুযায়ী গণনা করা হয়।
৩. জ্বলনের এনথালপি পরিবর্তন
কোনো পদার্থ সম্পূর্ণরূপে অক্সিজেনের সঙ্গে জ্বলে পানি ও কার্বন ডাই অক্সাইডে রূপান্তরিত হওয়ার সময় নির্গত তাপকে জ্বলনের এনথালপি বলে। এটি মূলত শক্তি উৎপাদনের ক্ষেত্রে গুরুত্বপূর্ণ।
৪. দ্রবণের এনথালপি পরিবর্তন
যখন একটি দ্রব্য কোনো তরল দ্রাবকের মধ্যে দ্রবীভূত হয়, তখন নির্গত বা শোষিত তাপকে দ্রবণের এনথালপি বলে। এটি বিভিন্ন পদার্থের দ্রবণে প্রভাব ফেলে।
৫. বাষ্পীভবনের এনথালপি পরিবর্তন
কোনো তরল থেকে বাষ্পে পরিণত হওয়ার সময় যে তাপ শোষণ করা হয়, তাকে বাষ্পীভবনের এনথালপি বলে। এটি একটি প্রক্রিয়ার পর্যায় পরিবর্তনের জন্য গুরুত্বপূর্ণ।
৬. গলনের এনথালপি পরিবর্তন
কোনো কঠিন পদার্থ গলে তরলে পরিণত হওয়ার সময় শোষিত তাপকে গলনের এনথালপি বলে। এটি পদার্থের গলনাঙ্কের উপর নির্ভর করে।
৭. প্রাথমিক ও প্রান্তিক এনথালপি পরিবর্তন
এই পরিবর্তন সাধারণত একটি নির্দিষ্ট প্রক্রিয়ার শুরু এবং শেষের মধ্যে তাপের পরিবর্তন নির্দেশ করে।
৮. প্রতিস্থাপনের এনথালপি পরিবর্তন
একটি যৌগের এক বা একাধিক উপাদান প্রতিস্থাপিত হওয়ার সময় নির্গত বা শোষিত তাপকে প্রতিস্থাপনের এনথালপি বলা হয়।
৯. সমাপনের এনথালপি পরিবর্তন
যে তাপের কারণে একটি নির্দিষ্ট বিক্রিয়া সমাপ্ত হয়, সেটি হলো সমাপনের এনথালপি। এটি সাধারণত শক্তি চাহিদার বিষয়টি নির্ধারণে সহায়ক।
কক্ষ তাপমাত্রায় এসিড ও ক্ষারের বিক্রিয়ায় এক মোল পানি উৎপন্ন হলে যে তাপ উৎপন্ন হয় তাকে প্রশমন তাপ বলে।
সব তীব্র এসিড ও সব তীব্র ক্ষার পানিতে আয়নিত হয়ে যথাক্রমে সর্বাধিক OH- এবং H+ আয়ন দেয়, তাই সব তীব্র এসিড এবং তীব্র ক্ষারের মধ্যে আসলে একই বিক্রিয়া ঘটে। এর মানে সব তীব্র এসিড ও সব তীব্র ক্ষারের প্রশমন তাপ একই অর্থাৎ ধ্রুব হবে।
তীব্র এসিড ও তীব্র ক্ষারের প্রশমন তাপ ধ্রুবক এবং এর মান -57.34 kj/mol। তীব্র এসিড ও তীব্র ক্ষারের প্রশমন তাপ ধ্রুবক; কারণ তীব্র এসিড ও তীব্র ক্ষার হিসেবে যেটাকেই নেওয়া হোক না কেন, প্রশমন বিক্রিয়ায় এসিড থেকে প্রাপ্ত H+ আয়ন ও ক্ষার থেকে প্রাপ্ত OH- আয়ন বিক্রিয়া করে এক মোল পানি উৎপন্ন করে এবং পানি উৎপন্ন করতে -57.34 kj/mol তাপ উৎপন্ন হয়। এ জন্য তীব্র এসিড ও তীব্র ক্ষারের প্রশমন তাপের মান ধ্রুবক হয়।
প্রমাণ গঠন এনথালপি (Standard Enthalpy of Formation):
একটি যৌগের প্রমাণ গঠন এনথালপি হল সেই তাপ পরিবর্তনের পরিমাণ, যা একটি মোল যৌগ প্রমাণ অবস্থায় এর মৌলিক উপাদানগুলি থেকে গঠিত হতে গেলে হয়। এটি সাধারণত ২৫° সেলসিয়াস তাপমাত্রা এবং ১ বায়ুমণ্ডল চাপে পরিমাপ করা হয়।
উদাহরণস্বরূপ:
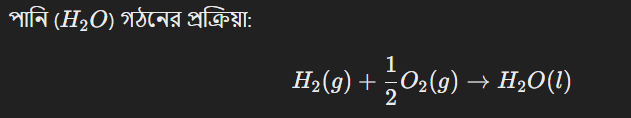
এই বিক্রিয়াটিতে যে তাপ পরিবর্তন হয়, তা হল পানির প্রমাণ গঠন এনথালপি। একে সাধারণত ∆H;দ্বারা প্রকাশ করা হয়।
গুরুত্বপূর্ণ বৈশিষ্ট্যসমূহ:
গাণিতিক ব্যবহার:
রসায়নবিদ্যায় প্রমাণ গঠন এনথালপি সাধারণত রাসায়নিক বিক্রিয়ার মোট তাপ পরিবর্তন (Delta H) হিসাব করতে ব্যবহৃত হয়।
∆H = ∑∆H; (উৎপাদন দ্রব্য) – ∑∆H; (প্রতিক্রিয়কের উপাদান)
সারাংশ:
প্রমাণ গঠন এনথালপি একটি রাসায়নিক যৌগের মৌলিক বৈশিষ্ট্য যা তাপ পরিবর্তনের মাধ্যমে এর গঠন নির্দেশ করে। এটি বিভিন্ন রাসায়নিক প্রক্রিয়ার তাপগতিবিদ্যা বোঝার জন্য অত্যন্ত গুরুত্বপূর্ণ।
হেসের সূত্র হলো একটি মৌলিক তাপরসায়ন নীতি যা বলে যে, একটি রাসায়নিক বিক্রিয়ার তাপ পরিবর্তন (ΔH) কেবলমাত্র প্রাথমিক এবং চূড়ান্ত অবস্থার উপর নির্ভর করে, বিক্রিয়ার পথের উপর নয়। এই সূত্র বিভিন্ন পরিস্থিতিতে প্রয়োগ করা হয়।
জটিল বিক্রিয়াগুলির জন্য ΔH নির্ণয় করতে হেসের সূত্র ব্যবহার করা হয়, যেখানে বিক্রিয়াটিকে একাধিক সহজ ধাপে বিভক্ত করা যায়। প্রত্যেক ধাপের তাপ পরিবর্তন যোগ করলেই মোট তাপ পরিবর্তন পাওয়া যায়।
উদাহরণ:
C(s) + O2(g) → CO2(g), ∆H = -393.5 kJ/mol CO(g)+1/2O2(g) → CO2(g), ∆H = -283.0 kJ/mol
C(s) +1/2O2(g) → CO(g), ∆H = -110.5 kJ/mol
মোট তাপ পরিবর্তন:
ΔΗ = (-110.5) + (-283.0) = -393.5 kJ/mol
কিছু বিক্রিয়ার তাপ পরিবর্তন সরাসরি নির্ণয় করা সম্ভব হয় না। হেসের সূত্র ব্যবহার করে এগুলির তাপ পরিবর্তন নির্ণয় করা যায়।
উদাহরণ:
C(graphite) + O2(g) → CO2(g), ΔΗ = -393.5 kJ/mol
C(diamond) + O2(g) → CO2(g), ΔΗ = -395.4 kJ/mol
এখন, হেসের সূত্র অনুযায়ী:
C(diamond) → C(graphite), ΔΗ = -393.5 - (-395.4) = 1.9 kJ/mol
হেসের সূত্র ব্যবহার করে গঠনের তাপ (heat of formation) থেকে সম্পূর্ণ বিক্রিয়ার তাপ পরিবর্তন নির্ণয় করা যায়।
ΔΗ = ∑ΔΗ; (পণ্য) – ∑∆H; (প্রতিক্রিয়ক)
উদাহরণ:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
ΔΗ (CO2) = -393.5 kJ/mol, ΔΗ (Η₂Ο) = -285.8 kJ/mol, ΔΗƒ(CH4) = -74.8 kJ/mol
ΔΗ = [(-393.5)+2(-285.8)]-[(-74.8)+2(0)] = -890.3 kJ/mol
হেসের সূত্র বন্ড ভাঙা ও নতুন বন্ড গঠনের জন্য তাপ পরিবর্তন নির্ণয় করতে সাহায্য করে।
DeltaH = (বন্ড ভাঙার জন্য শক্তি) – (বন্ড গঠনের জন্য শক্তি)
উদাহরণ:
H_{2}(g) + Cl_{2}(g) -> 2HCl(g) বন্ড শক্তি: H - H = 436kJ / m * ol Cl - Cl = 243kJ / m * ol H - Cl = 431kJ / m * ol Delta*H = [[436 + 243]] - [2(431)] = - 183kJ / m * ol
জ্বালানি যেমন মিথেন, পেট্রোল ইত্যাদির দহন তাপ নির্ণয়ের জন্য হেসের সূত্র ব্যবহার করা হয়। এটি জ্বালানির তাপীয় দক্ষতা নির্ণয়ে গুরুত্বপূর্ণ ভূমিকা পালন করে।
যেসব বিক্রিয়া সরাসরি করা সম্ভব নয়, যেমন কার্বনের ভিন্ন গঠন (গ্রাফাইট এবং ডায়মন্ড) এর মধ্যে রূপান্তর, হেসের সূত্র ব্যবহার করে এগুলোর তাপ পরিবর্তন নির্ণয় করা হয়।
উপসংহারে, হেসের সূত্র রাসায়নিক তাপীয় পরিবর্তন নির্ণয়ের একটি কার্যকরী ও প্রয়োজনীয় পদ্ধতি, যা জটিল বিক্রিয়াগুলির তাপ গাণিতিকভাবে নির্ণয়ে গুরুত্বপূর্ণ।
Read more