ধর, তোমার কাছে একটি কন্টেইনারে এক লিটার বিশুদ্ধ পানি আছে। তুমি জানো, পোলার যৌগ হবার কারণে পানি অণুগুলো খানিকটা বিয়োজনপ্রবণ; এর হাইড্রোজন পরমাণু তড়িৎঋণাত্মক অক্সিজেনের কাছে তার ইলেকট্রন হারিয়ে প্রোটন হিসেবে বেরিয়ে যেতে পারে। অম্ল-ক্ষারকের ব্রনস্টেড লাউরির মতবাদ অনুযায়ী এই প্রোটন মুক্ত থাকে না বরং আরেকটি পানির অণুর অক্সিজেন এর সাথে সন্নিবেশ সমযোজী বন্ধন গঠন করে ফেলে। অর্থাৎ এখানে প্রোটন দাতা পানির অণুটির আচরণ অম্লের মত, আর প্রোটনগ্রহীতা অণুটি হল ক্ষারক। 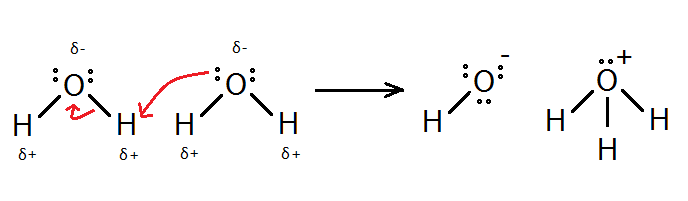
তবে মজার ব্যাপার হল পানি অম্ল বা ক্ষারক – কোনোটি হিসেবেই শক্তিশালী নয়। তাই যদি হয়ে থাকে তবে এখানে অনুবন্ধী অম্ল H3O+ এবং অনুবন্ধী ক্ষারক OH– বেশ শক্তিশালী হবার কথা এবং এরা তৈরি হওয়ামাত্রই বিপরীতমুখী বিক্রিয়া করে পানি বানিয়ে ফেলার কথা। আসলে এমনটাই ঘটে এবং তাই আমাদের বিক্রিয়াটি একমুখী নয়, বরং উভমুখী হিসেবে দেখানো উচিত। 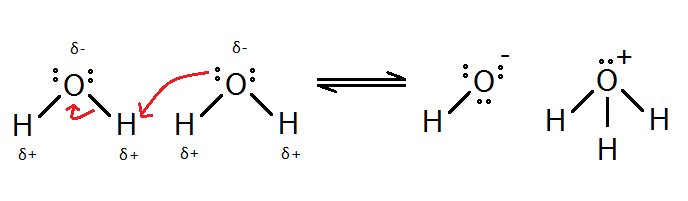
এই উভমুখী বিক্রিয়ার ক্ষেত্রে তাই একটা সাম্যাবস্থা আছে যেখানে দুই ধরণের বিক্রিয়াই একই বেগে চলবে। সাম্যাবস্থা থাকলে সেই সাম্যাবস্থার একটা সাম্য ধ্রুবকও থাকা উচিত। ভরক্রিয়ার সূত্রানুসারে এই সাম্যধ্রুবক K হবে –
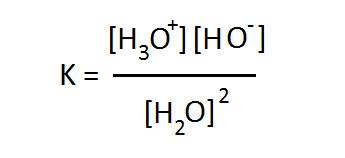
পানির স্ববিয়োজন বিক্রিয়ার সাম্যধ্রুবক বা পানির বিয়োজন ধ্রুবক (Dissociation Constant) এর রাশিমালা
আমরা অনেকেই পানির বিয়োজন এভাবে না লিখে পুরাতন নিয়মে (আরহেনিয়াস মতবাদকে পুঁজি করে) H2O → H+ + OH– লিখে অভ্যস্ত। যেভাবেই লেখা হোক না কেন, বক্তব্য মূলত একই। সরলীকরণের স্বার্থে আমরা এই লেখার বাকী অংশে হাইড্রোনিয়াম আয়নের স্থলে প্রোটন দিয়েই কাজ চালাব। তো ঐ সমীকরণকে আমলে নিলে বিয়োজন ধ্রুবকটি এভাবে লিখতে হয় –
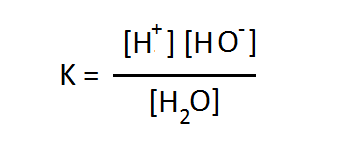
হাইড্রোনিয়াম আয়নের স্থলে প্রোটন লিখে K এর প্রকাশ
এতদূর সব ঠিক আছে। তবে K এর রাশিমালায় একটা জিনিস একটু অপ্রয়োজনীয় আর তা হল পানির ঘনমাত্রা। আগেই বলা হয়েছে, পানি শক্তিশালী এসিড বা ক্ষারক না হওয়ায় এর এরূপ বিয়োজন ঘটে খুব সামান্যই। ২৫ ডিগ্রি সেলসিয়াসে কোনো নির্দিষ্ট মুহূর্তে এক লিটার পানিতে যে পরিমাণ পানির অণু থাকে তাদের প্রতি ৫৫.৫ কোটির মধ্যে কেবল একটি পানির অণুই প্রোটন ত্যাগ করে এভাবে ভেঙ্গে যায়। অতএব যতটুকু পানি আমরা নিয়েছি তার ঘনমাত্রা প্রায় অপরবর্তীত থাকে বলে রায় দেওয়া যায় আর একারণেই [H2O] বলতে নতুন কোনো হিসাব না করে গৃহীত পানির ঘনমাত্রাকেই ধরে নিলে সমস্যা হয় না (প্রসঙ্গত উল্লখ্য, বিশুদ্ধ পানির ঘনমাত্রা 55.5 molL-1; অর্থাৎ প্রতি এক লিটার বিশুদ্ধ পানিতে 1000g বা 55.5 mol পানি থাকে)।
বিয়োজন ধ্রুবক K এর সাথে পানির এই ঘনমাত্রা গুণ করে আমরা পাই নতুন আরেকটি ধ্রুবক Kw , যার নাম পানির আয়নিক গুণফল (Ionic Product of Water) 😀
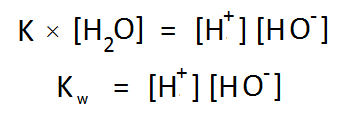
পানির বিয়োজনে প্রাপ্ত আয়নদের ঘনমাত্রার গুণফলের নাম তো “পানির আয়নিক গুণফল”-ই হওয়া উচিত
আমাদের এখন জানার ইচ্ছা হতে পারে, এই Kw এর মান কেমন হয়? এই উত্তর পেতে হলে বুঝতেই পারছ যে সর্বাগ্রে [H+] (আসলে H3O+ এর ঘনমাত্রা) এবং [OH–] এর মান জানা জরুরি। আমরা নিজেরাই বের করতে পারব এদের মান! কীভাবে? দেখ, তোমাকে বলা হয়েছে ২৫ ডিগ্রি সেলসিয়াসে প্রতি ৫৫.৫ কোটি বা 55.5×107 পানি অণুর একটি বিয়োজিত হয়ে একটি প্রোটন তৈরি করে এবং নিজে হাইড্রোক্সিলে পরিণত হয়। আবার আমরা একটু আগে দেখেছি পানির ঘনমাত্রা 55.5 molL-1 । আমরা যদি এক লিটারে থাকা এই 55.5 মোল পানি থেকে কত মোল H+ ও OH– তৈরি হতে পারে তা গণনা করতে পারি তবেই কেল্লা ফতে
ঐকিক নিয়মের আশ্রয় নেওয়া যায় এ ব্যাপারে। আমি এখানে প্রোটন দিয়ে হিসাব করেছি, হাইড্রক্সিলের হিসাবটাও হবে অনুরূপ কারণ পানি বিয়োজিত হয়ে সমপরিমাণ হাইড্রক্সিল ও প্রোটন তৈরি করে। 
অতএব, [H+] = [OH–] = 1×10-7 molL-1
তাই, ২৫ ডিগ্রি সেলসিয়াসে পানির আয়নিক গুণফল Kw = 1×10-14 mol2L-2
Kw এর যে মান আমরা মাত্র পেলাম এটা পড়তে অসুবিধা হয় কেননা এটি দুইটি অংশে বিভক্ত (পূর্ণসংখ্যার সাথে দশভিত্তিক আরেকটি অংশ গুণ আছে)। এমন সংখ্যার চেয়ে আমরা একটা পূর্ণসংখ্যা পড়তেই বেশি স্বচ্ছন্দ। এই উদ্দেশ্যে আমরা Kw এর মানের ঋণাত্মক লগারিদম (দশ ভিত্তিক) নিই যা একটা সুন্দর পূর্ণসংখ্যা উত্তর হিসেবে দেয়। এটাকেই বলা হয় pKw
pKw = -logKw
২৫ ডিগ্রি সেলসিয়াসে Kw এর এককবিহীন মান 1×10-14 হবার কারণে ঐ তাপমাত্রায় এর pKw হয় -log(1×10-14) বা, 14.
অন্যদিকে কোনো দ্রবণে থাকা প্রোটনের ঘনমাত্রার মানের ঋণাত্মক লগারিদম নিলে আমরা যা পাই তা হল pH। বিশুদ্ধ পানি নিরপেক্ষ (না এসিড, না ক্ষারক) কারণ এতে বিয়োজনের ফলে যে পরিমাণ প্রোটন উৎপন্ন হয় (এসিডের মত) ঠিক ততটুকুই হাইড্রোক্সিল আয়ন থাকে (ক্ষারকের ধর্ম)। ২৫ ডিগ্রি সেলসিয়াসে বিশুদ্ধ পানির pH গণনা করে তাই আমরা পাই –
pH = -log[H+] = -log(1×10-7) = 7
বিশুদ্ধ পানিতে এসিড যোগ করলে যেহুতু প্রোটনের ঘনমাত্রা বেড়ে যায় তাই তখন pH এর মান 7 থেকে বিচ্যুত হয়। উদাহরণস্বরূপ, প্রোটনের ঘনমাত্রা 1×10-7 molL-1 এর দশগুণ (1×10-6 molL-1) হলে pH হয় -log(1×10-6) = 6। সুতরাং অম্লীয় দ্রবণের pH 7 এর কম হয়। একইভাবে, ক্ষারক যোগ করলে [H+] এর মান হ্রাস পায় এবং pH 7 এর চেয়ে বেড়ে যায়।
প্রশ্ন হতে পারে, আমরা কেন এটাকে কেবল pH ই বলছি cH, mH ইত্যাদি কেন নয়। p বর্ণটি ব্যবহার করা হয় জার্মান শব্দ potenz এর অদ্যাক্ষর হিসেবে, যার অর্থ power বা শক্তি।
pH এর মত একইভাবে pOH নির্ণয় করা যায় দ্রবণের হাইড্রোক্সিল আয়নের ঘনমাত্রার মানের ঋণাত্মক লগারিদম নিলে। মজার ব্যাপার হল pH এবং pOH এর যোগফল সর্বদা pKw এর সমান হয়। এই প্রমাণটা তোমরা নিজেরাই করে দেখতে পারো। ২৫ ডিগ্রি সেলসিয়াসে পানির pOH তাই হাইড্রোক্সিল আয়নের ঘনমাত্রা থেকে সরাসরি বের করতে পারো অথবা pKw থেকে pH বাদ দিয়েও নির্ণয় করতে পারো। উভয়ক্ষেত্রেই উত্তর আসবে 7.
আমাদের একটা কমন মাইন্ডসেট হল বিশুদ্ধ পানি বলতেই pH বুঝি 7 বোঝায়। কিন্তু কথাটা কেবল মাত্র ২৫ ডিগ্রি সেলসিয়াস তাপমাত্রার পানির জন্য সত্য।
পানির বিয়োজন বিক্রিয়াটি একটি তাপহারী বিক্রিয়া। তাই তাপমাত্রা বাড়লে লা শাঁতেলিয়ার নীতি অনুযায়ী পানির ভাঙ্গন (সম্মুখমুখী বিক্রিয়া) ত্বরান্বিত হয় এবং অধিক পরিমাণ প্রোটন ও হাইড্রক্সিল আয়ন তৈরি হয়। স্বভাবতই এজন্য পানির আয়নিক গুণফল যায় বেড়ে। এই যেমন ৪০ ডিগ্রি সেলসিয়াসে Kw এর মান বেড়ে হয়ে যায় 2.916×10-14 mol2L-2
অর্থাৎ, [H+] × [OH–] = 2.916×10-14 mol2L-2
[H+]2 = 2.916×10-14 mol2L-2 (যেহেতু, [H+] = [OH–])
বা, [H+] = 1.482×10-7 molL-1
সুতরাং, pH = -log(1.482×10-7 ) = 6.77
যদি জিজ্ঞাস করি, এই ৪০ ডিগ্রি সেলসিয়াস তাপমাত্রায় পানির pOH কত হবে তখন ভুলেও 14 থেকে 6.77 বিয়োগ করে উত্তর বলা যাবে না। কারণ এই তাপমাত্রায় pKw তো আর 14 নয়, সেটারও পরিবর্তন ঘটেছে। আমি যে Kw ব্যবহার করেছি তা থেকে pKw নির্ণয় করতে হবে নতুন করে। দেখবে, এখানে pOH সেই 6.77 ই আসবে। তাই তোমাকে এটা বুঝতে হবে যে, তাপমাত্রা বাড়লে পানি অম্লীয় হয়ে গেল – এমনটা নয়। H+ বেশি তৈরি হয় ঐ তাপমাত্রায় তাই pH হয় কম, কিন্তু একসাথেই সমপরিমাণ OH–ও তৈরি হয় যা পানিকে নিরপেক্ষই রাখে। অন্যদিকে নিম্ন তাপমাত্রায় পানির আয়নিক গুণফল কমে যায় এবং ফলশ্রুতিতে pH বেড়ে যায়।