কর্বনের পারমাণবিক সংখ্যা 6, কার্বনের ইলেকট্রন বিন্যাস থেকে জানা যায় কার্বনের প্রথম কক্ষে 2টি এবং বাইরের কক্ষে 4টি ইলেকট্রন আছে । কার্বন পরমাণু বাইরের কক্ষের 4টি ইলেকট্রন, অন্য পরমাণুর বাইরের কক্ষের ইলেকট্রনের সঙ্গে চারটি ইলেকট্রন জোড় গঠন করে সমযোজ্যতা দ্বারা জৈব যৌগ উৎপন্ন করে ।
যেমন— মিথেন : জৈব যৌগের সরলতম যৌগ হল মিথেন (Methane) । যৌগটির সংকেত হল CH4 । এখানে কার্বন পরমাণুর সর্ববহিঃস্থ কক্ষে ইলেকট্রনগুলি চারটি হাইড্রোজেন পরমাণুর সহিত যুক্ত হয়েছে । এর গঠন হল -
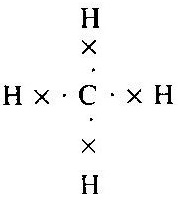
কার্বন পরমাণু আয়নীয় অর্থাৎ তড়িৎ-যোজী যৌগ উৎপন্ন করে না । কার্বন-কার্বন সমযোজ্যতা বন্ধন খুবই শক্তিশালী । অনেকগুলি কার্বন পরমাণু পরস্পরের সঙ্গে সমযোজ্যতা বন্ধন দিয়ে আবদ্ধ হয়ে দীর্ঘ কার্বন শৃঙ্খল উৎপন্ন করতে পারে । কার্বন পরমাণুগুলির নিজেদের মধ্যে যুক্ত হওয়ার এই ধর্মকে কার্বনের ক্যাটিনেশন (Catenation) বলে ।
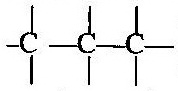
ক্যাটিনেশন (Catenation) :- যে ধর্মের জন্য কার্বন পরমাণুগুলি পরস্পর সমযোজী বন্ধনের (এক-বন্ধন, দ্বি-বন্ধন, ত্রি-বন্ধন) সাহায্যে পরস্পর যুক্ত হয়ে সুস্থিত কার্বন শৃঙ্খল গঠন করে, কার্বন পরমাণুর সেই বিশেষ ধর্মকে ক্যাটিনেশন বলে ।
একাধিক কার্বন পরমাণু এক-বন্ধন (-) (single bond), দ্বি-বন্ধন (=) (double bond) বা ত্রি-বন্ধন (≡) (triple bond) দ্বারা পরস্পর যুক্ত হয়ে বিভিন্ন জৈব যৌগ গঠন করতে পারে ।
[i] এক-বন্ধন (-) (singl bond):- যেমন, ইথেন অণুতে -
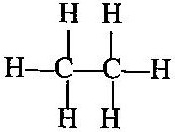
এবং একই রূপে ইথাইল অ্যালকোহলে কার্বন-কার্বন পরমাণুর মধ্যে এক-বন্ধন সৃষ্টি হয়ছে ।
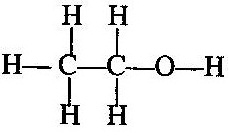
[ii] দ্বি-বন্ধন (=) (double bond):- যেমন ইথিলিন অণুতে দ্বি-বন্ধন দেখা যায় অর্থাৎ কার্বন-কার্বন পরমাণুর মধ্যে দ্বি-বন্ধন সৃষ্টি হয়ছে । 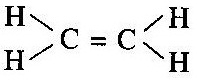
[iii] ত্রি-বন্ধন (≡) (triple bond):- যেমন অ্যাসিটিলিন অণুতে ত্রি-বন্ধন অর্থাৎ কার্বন-কার্বন পরমাণুর মধ্যে ত্রি-বন্ধন সৃষ্টি হয়ছে ।
H - C ≡ C - H
কিন্তু অজৈব যৌগের মধ্যে বন্ধন আয়নীয় ও সমযোজী দুটিই হতে পারে । অজৈব যৌগ সাধারণত আয়ানীয় বন্ধন দ্বারা যুক্ত : যেমন-NaCl, KCl, MgBr2, CaCl2 ইত্যাদি । কিন্তু কিছু কিছু অজৈব যৌগ আছে যারা সমযোজ্যতার দ্বারা যুক্ত হলেও আয়োনীয় যৌগের মতো ব্যবহার করে : যেমন- NH3, HCl, H2O, CO2 ইত্যাদি ।
Read more