প্রশ্ন-১. তড়িৎ রসায়ন কি?
উত্তর : তড়িৎ রসায়ন হলো রসায়নের একটি শাখা, যেখানে বিভিন্ন রাসায়নিক পদার্থের তড়িৎ পরিবাহী ধর্ম, তড়িৎ পরিবাহিতার প্রকারভেদ, তড়িৎ বিশ্লেষণ ও এর কার্যনীতি এবং এর সাথে জড়িত বিষয়গুলো পর্যালোচনা ও ব্যবহারিক প্রয়োগসমূহ আলোচনা করা হয়।
প্রশ্ন-২. গ্রাফাইট কী ধরনের পরিবাহী?
উত্তর : সুপরিবাহী।
প্রশ্ন-৩. কাচ, রাবার, পেট্রোল, চিনি কী ধরনের পরিবাহী?
উত্তর : অপরিবাহী।
প্রশ্ন-৪. লবণ সেতু ব্যবহারের উদ্দেশ্য কি?
উত্তর : তড়িৎ নিরপেক্ষতা বজায় রাখা।
প্রশ্ন-৫. উভমুখী তড়িৎদ্বার কয় ধরনের?
উত্তর : তিন ধরনের।
প্রশ্ন-৬. ভোল্টায়িক সেল কত সালে সর্বপ্রথম আবিষ্কার করা হয়?
উত্তর : ১৮০০ সালে সর্বপ্রথম ভোল্টায়িক সেল আবিষ্কার করা হয়।
প্রশ্ন-৭. তড়িৎ রাসায়নিক কোষ কাকে বলে?
উত্তর : যে তড়িৎ কোষে রাসায়নিক শক্তি বৈদ্যুতিক শক্তিকে রূপান্তরিত হয়, তাকে তড়িৎ রাসায়নিক কোষ বলে। যেমন- ডেনিয়েল কোষ।
প্রশ্ন-৮. সেকেন্ডারি নির্দেশক তড়িৎদ্বার কাকে বলে?
উত্তর : যে তড়িৎদ্বারের বিভব সরাসরি নির্ণয় করা যায় না, প্রাইমারি নির্দেশক তড়িৎদ্বার ব্যবহার করে নির্ণয় করা হয় তাকে সেকেন্ডারি নির্দেশক তড়িৎদ্বার বলে। যেমন– ক্যালোমোল ইলেকট্রোড।
প্রশ্ন-৯. প্রাইমারি নির্দেশক তড়িৎদ্বার কাকে বলে?
উত্তর : যে তড়িৎদ্বারের বিভব সরাসরি নির্ণয় করা যায় তাকে প্রাইমারি নির্দেশক তড়িৎদ্বার বলে। যেমনঃ প্রমাণ হাইড্রোজেন তড়িৎদ্বার।
প্রশ্ন-১০. তড়িৎ বিশ্লেষণ কী?
উত্তর : বিগলিত বা দ্রবীভূত তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে বিদ্যুৎ পরিবহনের সময় সে যৌগের বিয়োজন বা রাসায়নিক পরিবর্তনকে তড়িৎ বিশ্লেষণ বলা হয়।
প্রশ্ন-১১. তড়িৎ রাসায়নিক তুল্যাঙ্ক কাকে বলে?
উত্তর : কোন তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে এক কুলম্ব বিদ্যুৎ প্রবাহিত করলে বা এক অ্যাম্পিয়ার বিদ্যুৎ এক সেকেন্ড যাবৎ প্রবাহিত করলে তড়িৎদ্বারে যে পরিমাণ জমা হবে বা দ্রবীভূত হবে তাকে তড়িৎ রাসায়নিক তুল্যাঙ্ক বলে।
প্রশ্ন-১২. তড়িৎ বিশ্লেষ্য কি?
উত্তর : যে সব যৌগ বিগলিত বা পানিতে দ্রবীভূত অবস্থায় বিদ্যুৎ পরিবহন করে এবং সেই সাথে রাসায়নিক পরিবর্তন ঘটে তাদেরকে তড়িৎ বিশ্লেষ্য বলা হয়।
প্রশ্ন-১৩. তড়িৎ পরিবাহী কাকে বলে?
উত্তর : যে সমস্ত পদার্থের মধ্যদিয়ে বিদ্যুৎ প্রবাহিত হতে পারে তাকে তড়িৎ পরিবাহী বলে।
প্রশ্ন-১৪. ফুয়েল সেল কী?
উত্তর : রাসায়নিক বিক্রিয়ার মাধ্যমে বিদ্যুৎ তৈরির যান্ত্রিক কৌশলকে জ্বালানি বা ফুয়েল সেল বলে।
প্রশ্ন-১৫. কোষের তড়িচ্চালক বল কী?
উত্তর : তড়িৎ রাসায়নিক কোষের বর্তনী খোলা থাকা অবস্থায় তড়িৎদ্বার দুটির মধ্যে যে বিভব পার্থক্য হয়, তাকে কোষের তড়িচ্চালক বল (EMF) বলে। EMF এর একক ভোল্ট।
প্রশ্ন-১৬. জারণ অর্ধ বিক্রিয়া কাকে বলে?
উত্তর : জারণ-বিজারণ বিক্রিয়ার যে অংশে জারণ বিক্রিয়া ঘটে, তাকে জারণ অর্ধ বিক্রিয়া বলে।
প্রশ্ন-১৭. বিজারণ অর্ধ বিক্রিয়া কাকে বলে?
উত্তর : জারণ-বিজারণ বিক্রিয়ার যে অংশে বিজারণ বিক্রিয়া ঘটে, তাকে জারণ অর্ধ বিক্রিয়া বলে।
প্রশ্ন-১৮. ফ্যারাডের ১ম সূত্র কি?
উত্তর : তড়িৎ বিশ্লেষণের ফলে কোন তড়িৎদ্বারে সংঘটিত রাসায়নিক বিক্রিয়ার পরিমাণ তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে প্রবাহিত মোট তড়িতের সমানুপাতিক।
প্রশ্ন-১৯. করোসান কি?
উত্তর : করোসান হলো ধাতুর সঙ্গে পরিবেশে উপস্থিত বস্তুসমূহের রাসায়নিক বিক্রিয়ার ফলে ধাতুর ক্ষয় হওয়ার প্রক্রিয়া।
কোটিং কাকে বলে?
উত্তর : কোন বস্তুকে পরিবেশ থেকে রক্ষা, তার গুণাগুণ ও সৌন্দর্য এবং স্থায়িত্ব ও কার্যকারিতা বৃদ্ধির জন্য, পণ্য তলে যে পাতলা প্রলেপ দেয়া হয়, তাকে আস্তরণ বা কোটিং (Coating) বলে। যেমন- রং এর কোটিং।
প্লেটিং কাকে বলে?
উত্তর : কোন ধাতব পদার্থের পণ্যকে পরিবেশ থেকে রক্ষা, দীর্ঘ স্থায়িত্ব , ক্রেতার আকর্ষণ বৃদ্ধিসহ অন্যান্য গুণাবলি বৃদ্ধি ও অর্জনের লক্ষ্যে অন্য কোন ধাতব পদার্থের সাহায্যে পণ্য পৃষ্ঠে যে প্রলেপ বা আস্তরণ দেয়া হয়, তাকে প্লেটিং (Plating) বলে।
সকল পদার্থের তড়িৎ পরিবহন ক্ষমতা এক নয়। আবার কিছু কিছু পদার্থ তড়িৎ পরিবহনই করতে পারে না। তড়িৎ পরিবহনের ক্ষমতার উপর ভিত্তি করে পদার্থসমূহকে দুই ভাগে ভাগ করা যায়। যথা :
১. তড়িৎ অপরিবাহী (Insulator) : যে সকল পদার্থের মধ্যদিয়ে তড়িৎ প্রবাহিত অর্থাৎ চলাচল করতে পারে না তাদের তড়িৎ অপরিবাহী বলা হয়। সাধারণত সমযোজী যৌগসমূহই তড়িৎ পরিবহনে অক্ষম। যেমন— কাঁচ, রাবার, চিনি, পেট্রোল ইত্যাদি। এ ছাড়া প্রায় সকল অধাতব মৌলসমূহই তড়িৎ অপরিবাহী।
২. তড়িৎ পরিবাহী (Conductor) : যে সমস্ত পদার্থের মধ্যদিয়ে তড়িৎ প্রবাহিত হতে পারে তাদের তড়িৎ পরিবাহী বলা হয়। যেমন— সকল ধাতুসমূহ, এসিড এবং ক্ষারের দ্রবণ, সকল লবণের দ্রবণ ও গ্রাফাইট, সোনা, রূপা, কপার ইত্যাদি।
তড়িৎ পরিবাহীর প্রকারভেদ (Classification of electrical conductors)
তড়িৎ পরিবহনের কৌশলের উপর নির্ভর করে তড়িৎ পরিবাহী পদার্থসমূহকে দুই ভাগে ভাগ করা যায়। যেমন :
- ধাতব পরিবাহী (Metallic Conductor ) : যে সকল তড়িৎ পরিবাহী পদার্থের মধ্যদিয়ে বিদ্যুৎ প্রবাহের সময় পদার্থের কোনোরূপ রাসায়নিক পরিবর্তন হয় না , তাদেরকে ধাতব পরিবাহী বলা হয়। সাধারণত ইলেকট্রনের প্রবাহের ফলে তড়িৎ প্রবাহিত হয় বলে ধাতব পরিবাহীসমূহকে ইলেকট্রনীয় পরিবাহীও বলা হয়। যেমন : সকল ধাতু, গ্রাফাইট (গ্রাফাইট অধাতব কঠিন মৌল হলেও সেটির মধ্য দিয়ে ইলেকট্রনের প্রবাহ ঘটে)। তাপমাত্রা বৃদ্ধির সাথে ধাতব পরিবাহীর পরিবাহীতা হ্রাস পায়। যেহেতু রাসায়নিক পরিবর্তন ঘটেনা তাই এটি ভৌত পদ্ধতি।
- তড়িৎ বিশ্লেষ্য পরিবাহী (Electrolytic Conductor) : যে সকল তড়িৎ পরিবাহী পদার্থের মধ্যদিয়ে বিদ্যুৎ প্রবাহিত করলে, পদার্থসমূহ রাসায়নিকভাবে পরিবর্তিত হয়ে নতুন ধর্ম বিশিষ্ট পদার্থে পরিণত হয় তাদের তড়িৎ বিশ্লেষ্য পরিবাহী বলা হয়। তড়িৎ বিশ্লেষ্য পদার্থসমূহ বিগলিত বা দ্রবীভূত অবস্থায় তড়িৎ পরিবহন করে এবং তড়িৎ পরিবহনের সময় পরিবাহীসমূহ বিশ্লেষিত হয়ে নতুন পদার্থে পরিণত হয়। এক্ষেত্রে ধনাত্মক ও ঋণাত্মক আয়নের মাধ্যমে তড়িৎ প্রবাহ ঘটে।
- ধনাত্মক আয়ন যে দিকে প্রবাহিত হয় তড়িৎ প্রবাহ সেদিকে এবং ঋণাত্মক আয়ন যেদিকে প্রবাহিত হয় তড়িৎ প্রবাহ তার বিপরীত দিকে ঘটে। যেহেতু তরলের মধ্য দিয়ে ক্যাটায়নগুলো ক্যাথোডে এবং অ্যানায়নগুলো অ্যানোডে যায় সেহেতু তড়িৎ বিশ্লেষ্য পদার্থের মধ্যে সর্বদা অ্যানোড থেকে ক্যাথোডে তড়িৎ প্রবাহ হয়। যেমন— সকল লবণসমূহের দ্রবণ, এসিড, ক্ষার ইত্যাদি।
তড়িৎ বিশ্লেষ্য পদার্থসমূহ আবার দুই প্রকার। যথা—
- তীব্র তড়িৎ বিশ্লেষ্য (Strong Electrolyte) : যে সকল তড়িৎ বিশ্লেষ্য পদার্থসমূহ দ্রবণে প্রায় সম্পূর্ণরূপে আয়নিত অবস্থায় থাকে তাদেরকে তীব্র তড়িৎ বিশ্লেষ্য পদার্থ বলা হয়।
- মৃদু তড়িৎ বিশ্লেষ্য (Weak Electrolyte) : যে সকল তড়িৎ বিশ্লেষ্য পদার্থ দ্রবণে আংশিক আয়নিত অবস্থায় থাকে তাদের মৃদু তড়িৎ বিশ্লেষ্য পদার্থ বলা হয়।
তড়িৎ বিশ্লেষ্যের পরিবাহিতা (Conductivity of electrolytes)
আয়নিক যৌগের জলীয় দ্রবণে অথবা গলিত অবস্থায় তড়িৎ বা বিদ্যুত পরিবহন করার ক্ষমতাকে তড়িৎ বিশ্লেষ্যের পরিবাহিতা বলে। পরিমাণগত ভাবে তড়িৎ বিশ্লেষ্যের রোধের ব্যাস্তানুপাতিক হলো ঐ তড়িৎ বিশ্লেষ্যের পরিবাহিতা। তড়িৎ বিশ্লেষ্যে পরিবাহীর মধ্য দিয়ে তড়িৎ প্রবাহিত হওয়ার কালে আয়নগুলো দ্বারা তড়িৎ বহনের বিরুদ্ধে ঐ পরিবাহী যা বাধা সৃষ্টি করে, তাকে ঐ তড়িৎ বিশ্লেষ্য পরিবাহীর রোধ বলে। যেমন কোনো তড়িৎ বিশ্লেষ্যের রোধ R এবং পরিবাহিতা L হলে, তখন L=R1
পরিবাহিতার একক : পরিবাহিতার একক =রোধের একক1
CGS পদ্ধতিতে পরিবাহিতার একক হলো ওহম−1 (ohm−1) SI পদ্ধতিতে পরিবাহিতার একক হলো সিমেন্স। সিমেন্স S প্রতীক দ্বারা প্রকাশ করা হয়। 1S=1ohm−1
- তড়িৎ বিশ্লেষ্য দ্রবণের মধ্য দিয়া তড়িৎ প্রবাহ ওহমের সূত্র মেনে চলে।
- কঠিন পরিবাহীর বেলায় রধ (resistance) যেমন পরিমাণ করা হয়, তেমনি তড়িৎ বিশ্লেষ্যের বেলায় রোধের পরিবর্তে পরিবাহিতা (conductance) পরিমাপ করা হয়।
এন্টিমনি
ইন্ডিয়াম
এলুমিনিয়াম
কোনটিই নয়
তড়িৎ বিশ্লেষ্যের পরিবাহিতার প্রকারভেদ(Different types of conductance) :
(১) তড়িৎ বিশ্লেষ্যের আপেক্ষিক পরিবাহিতা [ Κ (Kappa) ]
(২) তড়িৎ বিশ্লেষ্যের তুল্য পরিবাহিতা Λ (Lambda) ]
(৩) তড়িৎ বিশ্লেষ্যের মোলার পরিবাহিতা [ Λm বা , μ(MU) ]
(১) তড়িৎ বিশ্লেষ্যের আপেক্ষিক পরিবাহিতা(Specific conductance of electrolytes):
1cm দূরত্বে থাকা ও 1cm2 প্রস্থচ্ছেদ বিশিষ্ট দুটি তড়িৎদ্বারের মধ্যবর্তী তড়িৎ বিশ্লেষ্য দ্রবনের রোধকে ঐ তড়িৎ বিশ্লেষ্যের আপেক্ষিক রোধ (ρ ) বলে। আপেক্ষিক রোধের বিপরীত রাশিকে আপেক্ষিক পরিবাহিতা বলা হয়।
আপেক্ষিক পরিবাহিতাকে Κ (Kappa) প্রতীক দ্বারা প্রকাশ করা হয়।
∴ আপেক্ষিক পরিবাহিতা, K=ρ1=RA1=(R1)×(A1)= দ্রবনের পরিবাহিতা × সেল ধ্রুবক
[ ∴ দ্রবণের পরিবাহিতা =R1 এবং সেল গুণাঙ্ক/ধ্রুবক =Al ]
আপেক্ষিক পরিবাহিতার একক (Unit of relative conductance):
CGS পদ্ধতিতে আপেক্ষিক পরিবাহিতা Κ এর একক =R1×Al
=রোধের এককদৈর্ঘ্যের এককক্ষেত্রফলের একক1=ওহম1×(সেমি)2সেমি=ওহম−1সেমি −1(ohm−1cm−1)
কোনো তড়িৎ বিশ্লেষ্যের এক গ্রাম তুল্যভর পরিমাণের দ্রবণকে এক সেন্টিমিটার (1cm) দুরত্বে থাকা দুটি উপযুক্ত তড়িৎদ্বারের মধ্যবর্তী স্থানে রাখলে তড়িৎ প্রবাহে দ্রবণটির যে পরিবাহিতা হয়, তাকে ঐ তড়িৎ বিশ্লেষ্যের তুল্য পরিবাহিতা বলে। তুল্য পরিবাহিতাকে Λ (Lamda) প্রতীক দ্বারা প্রকাশ করা হয়।
(২) তড়িৎ বিশ্লেষ্যের তুল্য পরিবাহিতা (Equivalent conductivity of electrolytes):
তুল্য পরিবাহিতা, Λ=ΚVeq.=Κ Vmolarতুল্য সংখ্যা (e)=Κ1C×ⅇ=Κ1000C×ⅇ
[C এর একক mol L-1 হলে]
Λ=κ×Veq.=κ× তুল্য সংখ্যা (e)Vmolar =κ×C×e1=κ×C×e1000
তুল্য পরিবাহিতার একক(Unit of equivalent conductivity):
Λ=κ×Veq=ohm−1 cm−1×cm3( g− equiv )−1=ohm−1 cm2( g− equiv )−1
(৩) তড়িৎ বিশ্লেষ্যের মোলার পরিবাহিতা(Molar conductivity of electrolytes):
কোনো তড়িৎ বিশ্লেষ্যের এক মোল পরিমাণের দ্রবণকে এক সেন্টিমিটার (1cm) দুরত্বে থাকা দুটি উপযুক্ত তড়িৎদ্বারের মধ্যবর্তী স্থানে রাখলে তড়িৎ প্রবাহে দ্রবণটির যে পরিবাহিতা হয়, তাকে ঐ তড়িৎ বিশ্লেষ্যের মোলার পরিবাহিতা বলে। মোলার পরিবাহিতাকে Λmপ্রতীক দ্বারা প্রকাশ করা হয়। V আয়তনের দ্রবণে এক মোল তড়িৎ বিশ্লেষ্য থাকলে মোলার পরিবাহিতা ও আপেক্ষিক পরিবাহিতার মধ্যে নিম্নরূপ সম্পর্ক হয়:
Λm=κ×VMolar [Vmolar = ঘনমাত্রা (C)1]
মোলার পরিবাহিতার একক(Unit of molar conductivity):
∴Λm এর একক =kappa এরএকক×ঘনমাত্রার একক 1=Ohm−1 cm−1× cm3 mol1
আপেক্ষিক পরিবাহিতা, κ=ρ1=(R1)×(A1)
তুল্য পরিবাহিতা, Λ=κ× তুল্য সংখ্যা Vmolar
মোলার পরিবাহিতা, Λm=κ×VMolar
3.5cm2 কার্যকর ক্ষেত্রফল এবং 0.6cm পারস্পরিক দুরত্বে রাখা দুটি তড়িৎদ্বারে মধ্যে 0.5 M H2SO4 দ্রবণ রাখলে সিস্টেমটির বৈদ্যুতিক রোধ 520ohm পাওয়া যায়। তাহলে, দ্রবণটির আপেক্ষিক তুল্য এবং মোলার পরিবাহিতা নির্ণয় কর।(If 0.5M H2SO4 solution is kept between two electrodes with an effective area of 3.5cm2 and 0.6m distance, we get 520 ohm electrical resistance. Define the relative equivalent conductivity and molar conductivity of the solution.)
Solution: আপেক্ষিক পরিবাহিতা =ρ1=R1⋅ A1=κ( kappa )
∴K=5201×3.50.6ohm−1 cm−1=3.2967×10−4ohm−1 cm−1(Ans.)
তুল্য পরিবাহিতা নির্ণয়ের ক্ষেত্রে,
0.5 M H2SO4 দ্রবণ মানে 1000cm3 দ্রবণে 0.5 mole বা 49g H2SO4 বা H2SO4 এর একক তুল্যভর বিদ্যমান।
তাহলে, Veq=1000 cm3
∴ তুল্য পরিবাহিতা =Λ=κVeq=(3.2967×10−4×1000)ohm−1 cm2( g.equiv )−1
=0.32967ohm−1 cm2 (g.equiv) −1(Ans.)
মোলার পরিবাহিতা নির্ণয়ের ক্ষেত্রে, 0.5 mole H2SO4 আছে 1000 cm3 এ
1 mole H2SO4 আছে 2000cm3 এ
∴ Vmolar =2000 cm3
∴ মোলার পরিবাহিতা =μ=κVmolar =0.65934ohm−1 cm2 mole −1
তড়িৎ বিশ্লেষণ ও ফ্যারাডের সূত্র (Electrolysis and Faraday’s Law)
প্রশ্নঃ ইলেক্ট্রনীয় পরিবাহী এবং ইলেকট্রোলাইটিক পরিবাহীর মধ্যে পার্থক্য লিখ। অথবা, ধাতব পরিবাহী এবং তড়িৎ বিশ্লেষ্যের মধ্যে পার্থক্য লিখ ।(Q. Write the difference between electronic conductor and electrolytic conductor. Or, write the difference between metalic conductor and electrolytic analysis)
উত্তরঃ
ধাতব পরিবাহী এবং তড়িৎ বিশ্লেষ্যের মধ্যে পার্থক্যঃ
| ধাতব পরিবাহী | তড়িৎ বিশ্লেষ্য পরিবাহী |
| ইলেকট্রন প্রবাহের ফলে তড়িৎ প্রবাহ সৃষ্টি হয়। অণু পরমাণুর স্থানান্তর হয় না। | আয়নের চলাচলে তড়িৎ পরিবাহিতা ঘটে। |
| তড়িৎ প্রবাহের সময় রাসায়নিক বিক্রিয়া ঘটে না। শুধুমাত্র তাপের উদ্ভব ঘটে। এটি ভৌত পরিবর্তন। | তড়িৎ প্রবাহের ফলে রাসায়নিক বিক্রিয়া ঘটে এবং তাপের উদ্ভব ঘটে। |
| ইলেক্ট্রন প্রবাহের বিপরীত দিককে বিদ্যুৎ প্রবাহের দিক হিসেবে ধরে নেয়া হয়। | তড়িৎ প্রবাহ ঘটে অ্যানোড থেকে ক্যাথোডের দিকে। |
| তাপমাত্রা বৃদ্ধির ফলে পরিবাহিতা হ্রাস পায়। কারণ এর ফলে রোধ বৃদ্ধি পায়। | তাপমাত্রা বৃদ্ধির ফলে পরিবাহিতা বৃদ্ধি পায়। |
| চাপের কোন প্রভাব নেই। | বাহ্যিক চাপ বাড়লে পরিবাহিতা বৃদ্ধি পায়। |
| ওহ্মের সূত্র প্রযোজ্য। | ফ্যারাডের সূত্র প্রযোজ্য। |
প্রশ্নঃ তড়িৎ বিশ্লেষণ, অ্যানোড (জারণ ঘটে) ও ক্যাথোড (বিজারণ ঘটে) বলতে কী বুঝ?(What is electrolysis, anode and cathode?)
উত্তরঃ
তড়িৎ বিশ্লেষণ (Electrolysis): যে প্রক্রিয়ায় বিগলিত বা কোন উপযুক্ত দ্রাবকে দ্রবীভূত অবস্থার কোন তড়িৎ বিশ্লেষ্য পদার্থের মধ্য দিয়ে বিদ্যুৎ প্রবাহের ফলে সেই যৌগের বিয়োজনের মাধ্যমে রাসায়নিক বিক্রিয়া সংঘটিত হয় তাকে তড়িৎ বিশ্লেষণ বলে।
অ্যানোড ও ক্যাথোড (Anode and Cathode): দুটি তড়িৎদ্বারের মধ্যে যে তড়িৎদ্বারে জারণ ঘটে তাকে অ্যানোড এবং যে তড়িৎদ্বারের বিজারণ ঘটে তাকে ক্যাথোড বলে।
প্রশ্নঃ বিশুদ্ধ পানি ও বিশুদ্ধ HCI তড়িৎবিশ্লেষ্য নয় কিন্তু এই দুটির মিশ্রণ তীব্র তড়িৎ বিশ্লেষ্য পদার্থ কেন?(Pure water and pure HCl are not electrolyte but why is the mixture of these two strong-electrolyte?)
উত্তরঃ
কোনো তড়িৎ বিশ্লেষ্যের মধ্যে আয়নের উপস্থিত আবশ্যিক । বিশুদ্ধ পানিতে খুব সামান্য পরিমাণ H+ ও OH− আয়ন থাকে বলে বিশুদ্ধ পানি তড়িৎ পরিবহন করে না। তাই বিশুদ্ধ পানি তড়িৎ বিশ্লেষ্য নয়। অনুরূপভাবে, বিশুদ্ধ HCl সমযোজী যৌগ বলে বিশুদ্ধ HCl ও তড়িৎ পরিবহন করে না । HCl একটি পোলার সমযোজী যৌগ।
কিন্তু পানির মধ্যে বিশুদ্ধ HCl যোগ করলে পোলার HCl অণু, পানির অণুর দ্বারা দ্রাবকায়িত হয়ে স্থায়ী H3O+ ও CI− আয়ন সৃষ্টি করে।
ফলে দ্রবণ [HCl+H2O⇋H3O++CI−] উত্তম পরিবাহী হয়। এ কারণে HCl এর জলীয় দ্রবণ তড়িৎ বিশ্লেষ্য পদার্থ।
প্রশ্ন: লঘু NaCl দ্রবণ, লঘু CH3COOH দ্রবণ, লঘু HCl দ্রবণ ও লঘু চিনির দ্রবণের পরিবাহিতার ক্রম এর ব্যাখ্যা কর। (Explain the order of conductivity of light NaCl solution, light CH₃COOH, light HCl solution and light sugar solution.)
উত্তর:
লঘু HCl ও লঘু NaCl তীব্র তড়িৎ বিশ্লেষ্য পদার্থ। এরা দ্রবণে সম্পূর্ণ বিয়োজিত হয়। CH3COOH একটি দুর্বল তড়িৎ বিশ্লেষ্য পদার্থ। দ্রবণে এর অধিকাংশ অণু অবিয়োজিত অবস্থায় থাকে। চিনি একটি তড়িৎ অবিশ্লেষ্য পদার্থ। আবার H+ আয়নের তড়িৎ পরিবাহিতা অন্যান্য আয়ন থেকে অনেক বেশি বলে উপযুক্ত পদার্থগুলির তড়িৎ পরিবাহিতার উর্ধ্বক্রম। চিনির লঘু দ্রবণ < CH3COOH এর লঘু দ্রবণ < NaCl এর লঘু দ্রবণ < HCl এর লঘু জলীয় দ্রবণ।
প্রশ্নঃ 0.1M NH4OH অপেক্ষা 0.1M NaOH দ্রবণের তড়িৎ পরিবাহীতা বেশি কেন?(Why is the electric conductivity of 0.1M NaOH higher than that of 0.1M NH₄OH?)
উত্তরঃ
NaOH তীব্র তড়িৎ বিশ্লেষ্য পদার্থ, তাই 0.1M দ্রবণে এটি প্রায় সম্পূর্ণরূপে বিয়োজিত হয়ে Na+ ও OH− আয়ন উৎপন্ন করে। কিম্ভ NH4OH মৃদু তড়িৎ বিশ্লেষ্য, তাই 0.1M দ্রবণে এটি আংশিকভাবে বিয়োজিত হয়। সুতরাং, একই আয়তনের 0.1M NHOH দ্রবণ অপেক্ষা 0.1M NaOH দ্রবণে অনেক বেশি সংখ্যক আয়ন থাকে। আয়নের সংখ্যাজনিত কারণে NH4OH দ্রবণ অপেক্ষা NaOH দ্রবণের পরিবাহিতা অনেক বেশি হবে।
প্রশ্নঃ তড়িৎ বিশ্লেষণ একটি জারণ বিজারণ প্রক্রিয়া ব্যাখ্যা কর। (Explain-“Electrolysis is an Oxidation-Reduction process”.)
উত্তরঃ
তড়িৎ বিশ্লেষণের সময় ক্যাটায়ন ক্যাথোড হতে এক বা একাধিক ইলেকট্রন গ্রহণ করে অর্থাৎ তা বিজারিত হয়। অপরদিকে অ্যানায়ন অ্যানোডে এক বা একাধিক ইলেকট্রন দান করে তা জারিত হয়। যেমন- তরলিত NaCl এর তড়িৎ বিশ্লেষণকালে নিম্নোক্ত বিক্রিয়া ঘটে-
NaCl(l)→Na+(l)+Cl−(l)
অ্যানোড (Anode): 2Cl−(l)→Cl2( g)+2e−
ক্যাথোড (Cathode): 2Na+(l)+2e−→2Na(s)
উপরোক্ত বিক্রিয়া হতে দেখা যায় যে, ইলেকট্রন দানের মাধ্যমে অ্যানোডে জারণ, ইলেকট্রন গ্রহনের মাধ্যমে ক্যাথোডে বিজারণ ঘটে। তাই তড়িৎ বিশ্লেষণ একটি জারণ বিজারণ প্রক্রিয়া।
প্রশ্ন : তড়িৎ বিশ্লেষণ যে সমস্ত বিষয়ের উপর নির্ভরশীল তা ব্যাখ্যা কর। (Explain the factors electrolysis depends on.)
উত্তরঃ
নিম্নোক্ত তিনটি বিষয়ের উপর নির্ভর করে।
যেমন-
১। তড়িৎ রাসায়নিক সারিতে আয়নের অবস্থান (Position of ions in electrochemical series): তড়িৎ বিশ্লেষণের সময় বিভিন্ন আয়নের চার্জমুক্ত হওয়ার প্রবণতার উপর ভিত্তি করে আয়নসমূহকে যে সারিতে সাজানো হয়েছে তাকে তড়িৎ রাসায়নিক সারি বলে। এ সারিতে যে আয়নের অবস্থান যত নিচে সে আয়নের চাজমুক্ত হওয়ার প্রবণতা তত বেশি । যেমন- কোন দ্রবণে Na+ এবং K+ উপস্থিত থাকলে Na+ চার্জমুক্ত হবে আগে ।
২। সমধর্মী আয়নের ঘনমাত্রার প্রভাব (Effect of the concentration of homogenous ions): তড়িৎ রাসায়নিক সারিতে কোন আয়নের অবস্থানের অগ্রাধিকারের চেয়ে ঐ আয়নের ঘনমাত্রার প্রভাব বেশি কার্যকরী। যেমন- 0.1M NaCl এর জলীয় দ্রবণে OH− এর ঘনমাত্রা 10−7molL−1 এর CI– এর ঘনমাত্রা 0.1molL−1 । তড়িৎ রাসায়নিক সারি অনুযায়ী OH− আয়ন আগে চার্জমুক্ত হওয়া উচিত। কিন্তু Cl− এর ঘনমাত্রা বেশী হওয়ায় এটি আগে চার্জমুক্ত হবে।
৩। তড়িৎদ্বারের প্রকৃতি (Nature of electrodes): তড়িৎদ্বারের প্রকৃতি অনেক সময় তড়িৎ রাসায়নিক সারির ব্যতিক্রম ঘটায়। যেমন- NaCl এর জলীয় দ্রবণে প্লাটিনাম তড়িৎদ্বার ব্যবহৃত হলে সক্রিয়তা সিরিজ মতে H+ চার্জমুক্ত হয় কিন্তু মার্কারী তড়িৎদ্বার ব্যবহৃত হলে Na+ আগে চার্জযুক্ত হয়।
প্রশ্ন : ফ্যারাডের তড়িৎ বিশ্লেষণের সূত্র দুটি বিবৃত ও ব্যাখ্যা কর।(State and explain Faraday’s two laws of electrolysis.)
উত্তরঃ
ফ্যারাডের প্রথম সূত্র (Faraday’s 1st Law): তড়িৎ বিশ্লেষণকালে যে কোন তড়িৎদ্বারে সংঘঠিত রাসায়নিক বিক্রিয়ার পরিমাণ অর্থাৎ কোনো তড়িৎদ্বারে সঞ্চিত বা দ্রবীভূত পদার্থের পরিমাণ প্রবাহিত বিদ্যুতের বা চার্জের পরিমাণের সমানুপাতিক।
এ সূত্র মতে,
W∝Q
W=ZQ
W=ZIt(Q=It)
[ Q= প্রবাহিত চার্জের পরিমাণ, W= সঞ্চিত বা দ্রবীভূত পদার্থের পরিমাণ ]
এখানে, Z হল তড়িৎ রাসায়নিক তুল্যাঙ্ক-
যদি I=1amp এবং t=1s হয় তাহলে,
Z=Wgmc−1 অর্থাৎ তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে 1c পরিমাণ বিদ্যুৎ বা চার্জ প্রবাহিত করা হলে, যে পরিমাণ পদার্থ ক্যাথোডে সঞ্চিত হয় বা অ্যানোড থেকে দ্রবীভূত হয়, সে পরিমাণকে তড়িৎ রাসায়নিক তুল্যাঙ্ক বলা হয়।
উল্লেখ্য যে তড়িৎ রাসায়নিক তুল্যাঙ্ক Z=nFM
বা, Z=n×96500CM
[ M = গ্রাম পারমানবিক ভর
n = যোজনী বা চার্জ
F = 96500c ]
∴W=nFMIt
এটিই ফ্যারাডের প্রথম সুত্রের গাণিতিক প্রকাশ
ফ্যারাডের ২য় সূত্র (Faraday’s 2nd Law): যদি বিভিন্ন তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে একই পরিমাণ বিদ্যুৎ একই সময় ধরে চালনা করা হয় তাহলে বিভিন্ন তড়িৎদ্বারে সঞ্চিত পদার্থের পরিমাণ তাদের নিজ নিজ পারমাণবিক ভরকে যোজনী বা চার্জ সংখ্যা দিয়ে ভাগ করলে যে ভাগফল পাওয়া যায়, তার সমানুপাতিক হবে ।
অর্থাৎ রাসায়নিক তুল্যাঙ্কের সমানুপাতিক হবে।
যদি Q পরিমাণ বিদ্যুৎ বা চার্জ প্রবাহের ফলে কোন তড়িৎদ্বারে W গ্রাম ভরের কোন পদার্থ দ্রবীভূত বা সঞ্চিত হয় তাহলে ফ্যারাডের ২য় সূত্র মতে,
WαVM [v = যোজনী, M = পারমাণবিক ভর]
বা, vMw=k (ধ্রুবক)
যদি তিনটি তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে একই পরিমাণ বিদ্যুৎ একই সময় ধরে চালনা করার ফলে এদের মধ্যে যথাক্রমে w1, w2, w3 পরিমাণ পদার্থ সঞ্চিত হয়। তাহলে ফ্যারাডের ২য় সূত্র মতে,
v1M1w1=v2M2w2=v3M3w3=k
Note: রাসায়নিক তুল্যাঙ্ক E=nM কোনো তড়িৎ বিশ্লেষ্যের মধ্যে 1F চার্জ প্রবাহিত করলে অ্যানোডে দ্রবীভূত বা ক্যাথোডে সঞ্চিত পদার্থের পরিমাণকে ঐ মৌলের রাসায়নিক তুল্যাঙ্ক বলে। তড়িৎ রাসায়নিক তুল্যাঙ্ক,
Z=nFM বা, n×96500CM (কোনো তড়িৎ বিশ্লেষ্যের মধ্যে 1C বিদ্যুৎ চার্জ প্রবাহিত করলে অ্যানোডে দ্রবীভূত বা ক্যাথোডে সঞ্চিত পদার্থকে ঐ মৌলের তড়িৎ রাসায়নিক তুল্যাঙ্ক বলে।
তড়িৎ রাসায়নিক তুল্যাঙ্ক ও রাসায়নিক তুল্যাঙ্কের মধ্যে সম্পর্ক হল Z=FE
প্রশ্ন : Ag এর তড়িৎ রাসায়নিক তুল্যাঙ্ক 0.00118gmc-1 বলতে কী বুঝ? (What is 0.00118gmc-1 electrochemical equivalent of Ag?)
উত্তরঃ
Ag এর তড়িৎ রাসায়নিক তুল্যাঙ্ক 0.00118gmc−1 এর অর্থ হল AgNO3 এর দ্রবণে তড়িৎ বিশ্লেষণের সময় এক কুলম্ব বিদ্যুৎ প্রবাহের ফলে কোন তড়িৎদ্বারে 0.00118gmc−1 সিলভার সঞ্চিত বা দ্রবীভূত হয়।
প্রশ্ন : তড়িৎ রাসায়নিক তুল্যাঙ্ক কী? (What is electrochemical equivalent?)
উত্তরঃ
তড়িৎ বিশ্লেষ্যের মধ্য দিয়ে এক কুলম্ব বিদ্যুৎ প্রবাহের ফলে কোন পদার্থের যত পরিমাণ অ্যানোডে দ্রবীভূত হয় বা ক্যাথোডে সঞ্চিত হয় তাকে সে পদার্থের তড়িৎ রাসায়নিক তুল্যাঙ্ক বলে।
প্রশ্ন : ফ্যারাডের ধ্রুবক কী?(What is Faraday’s constant?)
উত্তরঃ
প্রতি মোল e− এর চার্জকে ফ্যারাডে ধ্রুবক বলা হয়। অর্থাৎ ফ্যারাডে ধ্রুবক =96500cmol−1
প্রশ্ন : ফ্যারাডের তড়িৎ বিশ্লেষণের সূত্র হতে 1টি e− এর চার্জ নির্ণয় কর। (Find the charge of 1e− from Faraday’s law of electrolysis.)
উত্তরঃ
ফ্যারাডের প্রথম সূত্র মতে, এক মোল ইলেকট্রনের চার্জ সমান এক ফ্যারাডে।
অর্থাৎ, NAe−1=1F=96500C
এখানে, NA= অ্যাভোগেড্রো সংখ্যা,
e− = একটি ইলেকট্রনের চার্জ
∴e−=NA96500C=6.022×102396500C=1.602×10−19C
প্রশ্নঃ তড়িৎ প্রলেপন বা Electroplating কী?(What is electroplating?)
উত্তরঃ
তড়িৎ বিশ্লেষণের মাধ্যমে একটি ধাতুর তৈরি জিনিসপত্রের উপর অন্য একটি কম সক্রিয় ধাতুর প্রলেপ সৃষ্টি করাকে ইলেকট্রোপ্লেটিং বলে। সাধারণত উজ্জ্বলতা সৃষ্টি বা ক্ষয় রোধ করার জন্য এটি করা হয়।
প্রশ্ন : তড়িৎ দক্ষতা বলতে কী বুঝ?(What is electro efficiency?)
উত্তরঃ
কোন তড়িৎ বিশ্লেষণ প্রক্রিয়ায় ক্যাথোডে যে পরিমাণ পদার্থ সঞ্চিত হয় এবং যে পরিমাণ পদার্থ বা মৌল সঞ্চিত হওয়ার কথা, এ দুয়ের অনুপাতকে তড়িৎ দক্ষতা বলে। যেমন 1F তড়িৎ প্রবাহিত করলে নিকেল লবণের দ্রবণ থেকে ক্যাথোডে কাঙ্ক্ষিত 29.34g নিকেল জমা হওয়ায় পরিবর্তে 25.48 গ্রাম জমা হয়। বাকি 3.86g নিকেলের সমতুল্য 0.1326 গ্রাম H2 গ্যাস উৎপন্ন হয়।
∴ এ দ্রবণের তড়িৎ দক্ষতা= 29.3425.48=0.8648=86.48%
প্রশ্ন : ধাতুর সক্রিয়তা সিরিজ কী?(What is reactivity series of metals?)
উত্তর :
সংজ্ঞা : একক প্রতিস্থাপন বিক্রিয়ার মাধ্যমে ধাতুসমূহের সক্রিয়তার তুলনামূলক যে সারি রসায়নবিদেরা তৈরি করেছেন ধাতুসমূহের এ সারিকে ধাতুর সক্রিয়তা সিরিজ বলা হয়। এ সারিতে সবচেয়ে অধিক সক্রিয় ধাতুটিকে ওপরে এবং সবচেয়ে কম সক্রিয় ধাতুতে সারির নিচে দেয়া হয়েছে।
ধাতুর সক্রিয়তা সিরিজ : (Reactivity series of Metals)
সংজ্ঞা (Definiton):
ধাতব মৌলসমূহকে তাদের ইলেকট্রন ত্যাগের প্রবণতার তথা সক্রিয়তার নিম্নক্রম অনুসারে সাজিয়ে প্রাপ্ত সিরিজকে ধাতুর সক্রিয়তা সিরিজ বলা হয়।
বৈশিষ্ট্য (Characteristics):
ধাতুর সক্রিয়তা সিরিজের কতিপয় উল্লেখযোগ্য বৈশিষ্ট্য রয়েছে যা নিম্নরূপ:
(i) এই সিরিজে যে ধাতব মৌলের অবস্থান যত উপরে সেই মৌলটি তত বেশি সক্রিয়।
(ii) এই সিরিজে উপস্থাপিত যে কোনো মৌল তার নিচে অবস্থিত যে কোনো মৌলকে তার যৌগ থেকে (যখন দ্রবীভূত অবস্থায় থাকে) প্রতিস্থাপন করতে পারে।
প্রশ্ন: তড়িৎ বিশ্লেষ্যের পরিবাহিতা কোন কোন বিষয়ের উপর নির্ভর করে?(What are the factors conductance of electrolytes depend on?)
কোনো নির্দিষ্ট তাপমাত্রায় নির্দিষ্ট ঘনমাত্রার তড়িৎ বিশ্লেষ্যের পরিবাহিতা সবসময় নির্দিষ্ট থাকে। কিন্তু তড়িৎ বিশ্লেষ্যের ঘনমাত্রা পরিবর্তন করলে পরিবাহিতার মানের পরিবর্তন ঘটে। এক্ষেত্রে দুই ধরনের পরিবাহিতা নিয়ে ব্যাখ্যা করা হলো।
(ক) আপেক্ষিক পরিবাহিতা (Specific Conductance): কোনো দ্রবণের প্রতি cm3 এর পরিবাহিতাকে এর আপেক্ষিক পরিবাহিতা বলে। সুতরাং প্রতি সিসি আয়তনে আয়ন সংখ্যার উপর দ্রবণের আপেক্ষিক পরিবাহিতা নির্ভর করে। আধুনিক তত্ত্ব অনুসারে তীব্র তড়িৎ বিশ্লেষ্য পদার্থগুলো দ্রবণে সম্পূর্ণরূপে আয়নিত অবস্থায় থাকে। এ দ্রবণকে লঘু করলে দ্রাবকের প্রভাবে আন্ত:আনবিক আকর্ষণ হ্রাসের দরুন দ্রবণে কার্যকরী আয়নের মোট সংখ্যা কিছুটা বৃদ্ধি পায় বটে। কিন্তু প্রতি সিসিতে যে পরিমাণ আয়ন বাড়ে লঘুকরণের কারণে প্রতি সিসিতে তা অপেক্ষা অধিক হ্রাস পায়। তাই দ্রবণ লঘুকরণের সাথে সাথে তীব্র তড়িৎ বিশ্লেষ্য পদার্থগুলোর আপেক্ষিক পরিবাহিতা হ্রাস পেতে থাকে। মৃদু তড়িৎ বিশ্লেষ্য পদার্থগুলো সাধারণ ঘনমাত্রার দ্রবণে আংশিকভাবে বিয়োজিত হয়। এরূপ দ্রবণকে লঘু করলে বিয়োজনমাত্রা সামান্য পরিমাণে বাড়ে সত্য কিন্তু এতে প্রতি সিসিতে যে পরিমাণ আয়ন সংখ্যা বাড়ে লঘুকরণের দরুন প্রতি সিসিতে আয়ন সংখ্যা তা অপেক্ষা অধিক হ্রাস পায়। এ কারণে মৃদু তড়িৎ বিশ্লেষ্যের ক্ষেত্রেও লঘুকরণের ফলে আপেক্ষিক পরিবাহিতা হ্রাস পায়। অর্থাৎ তীব্র বা মৃদু যে কোন প্রকার তড়িৎ বিশ্লেষ্যের ক্ষেত্রে দ্রবণকে লঘু করলে আপেক্ষিক পরিবাহিতা হ্রাস পায়।
(খ) তুল্য পরিবাহিতা (Equivalent Conductance): দ্রবণের ১ গ্রাম তুল্য ওজন তড়িৎ বিশ্লেষ্য হতে উৎপন্ন মোট আয়নের পরিবাহিতাই হল দ্রবণটির তুল্য পরিবাহিতা। তীব্র তড়িৎ বিশ্লেষ্য পদার্থগুলো সব ঘনমাত্রাতেই সম্পূর্ণরূপে আয়নিত হতে পারে। এ দ্রবণকে আরও লঘু করলে ১ গ্রাম তুল্য ওজন তড়িৎ বিশ্লেষ্য হতে আর অধিক আয়ন পাওয়া যায় না। সুতরাং এ ধরনের দ্রবণ লঘু করলে তুল্য পরিবাহিতার কোনো পরিবর্তন হবে না। কিন্তু আয়নগুলোর মধ্যে পারস্পরিক আকর্ষণ থাকার কারণে গাঢ় দ্রবণে প্রতিটি আয়ন এর চারপাশের বিপরীত আয়নের সাথে আয়ন আবহমন্ডল (ionic atmosphere) সৃষ্টি করে পুঞ্জীভূত হয়ে থাকে। ফলে দ্রবণে ১ গ্রাম তুল্য ওজন পরিমাণ তড়িৎ বিশ্লেষ্য হতে প্রাপ্ত সব আয়ন পরিবাহিতায় অংশগ্রহণ করতে পারে না। কিন্তু দ্রবণ লঘু করলে দ্রাবকের প্রভাবে আয়ন আবহমন্ডল ভেঙ্গে গিয়ে আয়নগুলো বিচ্ছিন্ন হয়ে পড়ে। ফলে ১ গ্রাম তুল্য ওজনের তড়িৎ বিশ্লেষ্য হতে উৎপন্ন কার্যকরী আয়ন সংখ্যা দ্রবণ লঘুকরণের সাথে বাড়তে থাকে। আন্ত আয়নিক আকর্ষণ হ্রাস পায় ফলে তড়িৎ পরিবাহিতা বাড়ে। মৃদু তড়িৎ বিশ্লেষ্য পদার্থগুলো দ্রবণে আংশিক বিয়োজিত হয়। দ্রবণ লঘুকরণের সাথে মোট আয়ন সংখ্যাও বাড়ে। ফলে তুল্য পরিবাহিতা বাড়ে।
তড়িৎ রাসায়নিক কোষ ও নার্নস্ট সমীকরণ (Electrochemical Cells and Nernst’s Equation)
প্রশ্ন: তড়িৎ রাসায়নিক কোষ কী?(What is electrochemical cell?)
উত্তর:
যে তড়িৎ কোষে রাসায়নিক বিক্রিয়ার ফলে বিদ্যুৎ প্রবাহ সৃষ্টি হয় অর্থাৎ রাসায়নিক বিক্রিয়ার শক্তি বিদ্যুৎ শক্তিতে রূপান্তরিত হয় তাকে তড়িৎ রাসায়নিক কোষ বলে।
প্রশ্ন: অর্ধকোষ কী এবং অর্ধকোষ বিক্রিয়া বলতে কী বুঝ? (What is half cell and half-cell reaction?)
উত্তর:
কোন তড়িৎ রাসায়নিক কোষে প্রতিটি তড়িৎদ্বার তড়িৎ বিশ্লেষ্যের সংস্পর্শে থাকে। তড়িৎদ্বার এবং তড়িৎবিশ্লেষ্য যুগলকে একসাথে অর্ধকোষ বলা হয় এবং অর্ধকোষের সংঘটিত বিক্রিয়াকে অর্ধকোষ বিক্রিয়া বলে।
যেমন- ডেনিয়েল কোষে অ্যানোড অর্ধকোষ এবং এতে সংঘটিত বিক্রিয়া নিম্নরূপ-
Zn(s)∣ZnSO4(aq)
বা, Zn(s)∣Zn2+(aq) বা, Zn(s)/Zn2+(aq) বা, Zn(s),Zn2+(aq)
অর্ধকোষ বিক্রিয়া (Half-cell reaction) : Zn(s)→Zn2+(aq)+2e−
কোনো অর্ধকোষকে যেভাবে প্রকাশ করলে অ্যানোড হয় ঠিক উল্টোভাবে প্রকাশ করলে ক্যাথোড হবে।
প্রশ্ন : অর্ধকোষের শ্রেণিবিভাগ আলোচনা কর।(Deliberate the classification of half-cell.)
উত্তর:
অর্ধকোষের শ্রেণিবিভাগ নিম্নরূপ-
১। ধাতু এবং ধাতব আয়ন অর্ধকোষ (Metal and metallic ion half-cell):
এরূপ অর্ধকোষ কোনো ধাতুর সংস্পর্শে ঐ ধাতুর আয়নের দ্রবণ থাকে। এ প্রকার অর্ধকোষকে M/M2+(aq) প্রতীক দ্বারা লেখা হয়। ডেনিয়েল কোষের অর্ধকোষ দুটি এ শ্রেণির উদাহরণ:
যেমন- Zn(s)/Zn2+(aq):Cu(s)/Cu2+(aq)
এক্ষেত্রে অর্ধকোষ বিক্রিয়া হল:
M(s)⇋Mn+(aq)+ne− Zn(s)⇋Zn2+(aq)+2e−
Cu(s)⇋Cu2+(aq)+2e−
২। ধাতু এবং এর অদ্রবণীয় লবণের সমন্বয়ে গঠিত অর্ধকোষ(Metal and its insoluble salt half-cell) :
এরূপ অর্ধকোষে কোনো ধাতুকে এর কোনো অদ্রবণীয় লবণের মধ্যে ঢুকিয়ে রেখে ঐ অদ্রবণীয় লবণের অ্যানায়ন সম্বলিত একটি যৌগের দ্রবণ যোগ করা হয়। যেমন, Ag তারকে অদ্রবণীয় AgCl(s) এর মধ্যে ঢুকিয়ে রেখে এতে HCl বা, NaCl দ্রবণ যোগ করে সৃষ্ট অর্ধকোষটি হয়: Ag(s),AgCl(s)/Cl−(aq)
এই শ্রেণির ক্যালোমেল অর্ধকোষটি হল: Hg(l),Hg2Cl2( s)/Cl−(aq)
অ্যানোডরূপে ক্যালোমেল অর্ধকোষ বিক্রিয়া : 2Hg(l)+2Cl−⇋Hg2Cl2( s)+2e−
ক্যাথোডরূপে ক্যালোমেল অর্ধকোষ বিক্রিয়া : Hg2Cl2(s)+2e−⇋2Hg(l)+2Cl−(aq)
৩। ধাতুর অ্যামালগাম এবং ধাতব আয়ন অর্ধকোষ (Metal amalgam and metallic ion half-cell) :
অধিক সক্রিয় ধাতু ও পারদের (Hg) মিশ্রণ দ্বারা তৈরি ধাতু-অ্যামালগাম দণ্ডকে ঐ ধাতুর লবণের দ্রবণে ডুবিয়ে এরূপ অর্ধকোষ তৈরি করা হয়। তবে অ্যামালগাম ব্যবহার করায় ধাতুটির জারণ দ্বারা ধাতব আয়নে রূপান্তর নিয়ন্ত্রিত হয়। যেমন- সোডিয়াম অ্যামালগাম অর্ধকোষ Na.Hg(s)/Na+(aq)
এক্ষেত্রে অর্ধকোষ বিক্রিয়া হল: Na⋅Hg(s)⇋Na+(aq)+e−+Hg(l)
৪। জারণ বিজারণ অর্ধকোষ(Oxidation reduction half-cell):
কোন অবস্থান্তর ধাতুর দুটি ভিন্ন জারণ-সংখ্যা বিশিষ্ট দুটি লবণের দ্রবণে একটি নিষ্ক্রিয় ধাতুর (Pt বা Au) তার বৈদ্যুতিক পরিবাহীরূপে ডুবিয়ে এরূপ অর্ধকোষ তৈরি করা হয়। যেমন,
অর্ধ কোষ :
Pt,Fe2+(aq)/Fe3+(aq)Au,Sn2+(aq)/Sn4+(aq)
জারণ অর্ধকোষ বিক্রিয়া :
Fe2+(aq)⇋Fe3+(aq)+e−Sn2+(aq)⇋Sn4+(aq)+2e−
৫। গ্যাস অর্ধকোষ (Gas half-cell):
এরূপ অর্ধকোষ নিষ্ক্রিয় ধাতুর (Pt) তারকে H2 বা Cl2 গ্যাসের যৌগের দ্রবণে ডুবিয়ে রেখে 25°C ও 1 atm চাপে ঐ গ্যাসটিকে এ দ্রবণে বুদবুদ আকারে চালনা করা হয়। যেমন হাইড্রোজেন অর্ধকোষ।
Pt,H2(g)(1 atm)/H+(aq)(1M)H2(g)⇋2H+(aq)+2e−
প্রশ্ন : গ্যালভানিক কোষ বা ডেনিয়েল সেলের গঠন এবং কার্যপ্রণালী বর্ণনা কর।(Describe the structure and function of Galvanic cell or Deniel cell.)
উত্তর:
একটি কাচ বা চীনামাটির পাত্রের মাঝখানে একটি সরু ছিদ্রযুক্ত দেয়াল দিয়ে একভাগে ZnSO4 এবং অপরভাগে CuSO4 দ্রবণ নেয়া হয়। দ্রবণদ্বয়ের উচ্চতা সমান রাখা হয়। ZnSO4 দ্রবণে Zn এবং CuSO4 দ্রবণে Cu দন্ড নিমজ্জিত করে ও দুটিকে একটি তারের মাধ্যমে যুক্ত করা হয়।
অ্যানোড বিক্রিয়া: Zn(s)⟶Zn2+(aq)+2e−
ক্যাথোড বিক্রিয়া: Cu2+(aq)+2e−⟶Cu(s)
Zn(s)+Cu2+(aq)→Zn2+(aq)+Cu(s)
এ কোষটিকে নিম্নরুপে প্রকাশ করা যায়-
Zn(s)/Zn2+(aq)∣Cu2+(aq)/Cu(s);E0=1.1 V বা, Zn(s)/ZnSO4(aq)∣CuSO4(aq)/Cu(s);E0=1.1 V
প্রশ্ন: তড়িৎ বিশ্লেষ্য ও তড়িৎ রাসায়নিক কোষের মধ্যে পার্থক্য লেখ। অথবা ১ ও ২ নং কোষের পার্থক্য লেখ।(Write the difference between electrolytes and electrochemical cells. Or, Write the difference between 1 & 2.)


১। (i) নং কোষটি একটি তড়িৎ রাসায়নিক কোষ যার মধ্যে রাসায়নিক শক্তি তড়িৎ শক্তিতে রূপান্তরিত হয়।
(ii) নং কোষ একটি তড়িৎ বিশ্লেষ্য কোষ। যাতে বিদ্যুৎশক্তি রাসায়নিক শক্তিতে রূপান্তরিত হয়।
২। (i) নং কোষের বাহ্যিক বর্তনীতে বিদ্যুৎ উৎসের প্রযয়োজন হয় না। কিন্তু,
(ii) নং কোষের বাহ্যিক বর্তনীতে বিদ্যুৎ উৎসের প্রযয়োজন হয়।
৩। (i) নং কোষের অ্যানোড ও ক্যাথোড যথাক্রমে ধণাত্মক ও ঋণাত্মক চার্জযুক্ত।
(ii) নং কোষে তা বিপরীত চিহ্নযুক্ত হয়।
৪। (i) কোষে দুটি ভিন্ন তড়িৎ বিশ্লেষ্যের মধ্যে দুটি ভিন্ন তড়িৎদ্বার ব্যবহৃত হয়। কিন্তু,
(ii) নং কোষে একই তড়িৎ বিশ্লেষ্যের মধ্যে দুটি তড়িৎদ্বার ব্যবহৃত হয়।
৫। (i) নং কোষে জারণ বিজারণ বিক্রিয়া স্বতঃস্ফূর্তভাবে ঘটে। কিন্তু
(ii) নং কোষে উৎসের উপর নির্ভর করে।
৬। (i) নং কোষটি হল শক্তি উৎপাদী কোষ।
(ii) নং কোষ হল শক্তিগ্রাহী কোষ।
৭। (i) নং কোষে রাসায়নিক বিক্রিয়ায় বিমুক্ত ইলেকট্রন প্রবাহের ফলে তড়িৎ প্রবাহ সৃষ্টি হয়।
(ii) নং কোষে দ্রবণে বা গলিত অবস্থায় তড়িৎ বিশ্লেষ্য পদার্থে সৃষ্ট আয়ন দ্বারা তড়িৎ প্রবাহ ঘটে।
৮। (i) নং কোষে ইলেকট্রন প্রবাহের ঠিক বিপরীত দিকে তড়িৎ প্রবাহ ঘটে।
(ii) নং কোষে দ্রবণে বা গলিত তড়িৎ বিশ্লেষ্যর মধ্যে যেদিকে অ্যানায়নের পরিবহন ঘটে সেদিকেই তড়িৎ প্রবাহিত হয়।
৯। (i) নং কোষে অ্যানোডে জারণ ও ক্যাথোডে বিজারণ ঘটে। তবে অ্যানোডের উপাদান নিজে ইলেকট্রন ত্যাগ করে জারিত হয় এবং তড়িৎ বিশ্লেষ্য থেকে ক্যাটায়ন ক্যাথোডে ইলেকট্রন গ্রহণ করে বিজারিত হয় ও জমা পড়ে।
(ii) এ কোষেও অ্যানোডে জারণ ও ক্যাথোডে বিজারণ ঘটে তবে তড়িৎ বিশ্লেষ্য পদার্থ-আয়নীকরণের ফলে সৃষ্ট ঋণাত্মক আয়ন অ্যনোডে আকৃষ্ট হয়ে ইলেকট্রন ত্যাগ করে জারিত হয় এবং ধণাত্মাক আয়ন ক্যাথোডে গিয়ে ইলেকট্রন গ্রহণ করে বিজারিত হয়।

ডেনিয়েল Cell কে পরোক্ষ সংযোগের মাধ্যমে লবণ সেতুর মাধ্যমে তৈরি করা যায়।
Zn(s)∣∣Zn2+(aq)∥Cu2+(aq)∣∣Cu(s)
প্রশ্ন: লবণ সেতু কী? এটি ব্যবহারের সুবিধা কী? (What is salt-bridge? What are the benefits of using it?)
উত্তর:
দুটি অর্ধকোষের মধ্যে পরোক্ষ সংযোগ সাধনের জন্য বিশেষ লবণ যেমন- KCI, KNO3, NH4NO3 এর সম্পৃক্ত দ্রবণ ভর্তি U আকৃতির কাচনলের উভয়মূখকে তুলা দ্বারা বন্ধ করে অর্ধকোষদ্বয়ের উভয় তরলের মধ্যে ডুবিয়ে রাখা হয়। অর্ধকোষদ্বয়ের এরূপ পরোক্ষ সংযোগ সাধনকে লবণ সেতু বা Salt ব্রীজ বলা হয়। লবণ সেতুতে ব্যবহৃত লবণের বৈশিষ্ট্য হল এ লবণের ক্যাটায়ন ও অ্যানায়নের গতিবেগ সমান বা প্রায় হতে হবে। ব্যবহৃত লবণটি কোষ বিক্রিয়ায় অংশগ্রহণ করবে না। লবণ সেতুতে ব্যবহৃত লবণ অর্ধকোষের তড়িৎবিশেষ্যের সাথে কোনো বিক্রিয়া করবে না।
সুবিধা (Benefits):
(i) এটি উভয় তড়িৎ বিশ্লেষ্যের মধ্যে সংযোগ সাধন করে কোষের বর্তনী পূর্ণ করে।
(ii) লবণ সেতুর অভাবে জারণ অর্ধকোষে ধণাত্মক, বিজারণ অর্ধকোষে ঋণাত্মক আয়নের পরিমাণ বেড়ে যায়। ফলে উভয় অর্ধকোষে জারণ বিজারণ বিক্রিয়া বাধাগ্রস্থ হয়। অল্প সময়ের মধ্যে কোষ বিক্রিয়া তথা বিদ্যুৎ প্রবাহ বন্ধ হয়ে যায়। জারণ অর্ধকোষে ধণাত্মক আয়ন বেড়ে গেলে লবণ সেতু থেকে ঋণাত্মক আয়নের ব্যাপন ঘটে। অনুরূপভাবে বিজারন অর্ধকোষে ঋণাত্মক আয়ন বেড়ে গেলে লবণসেতু থেকে ধণাত্মক আয়নের ব্যাপন ঘটে। ফলে উভয় তরলে বৈদ্যুতিক নিরপেক্ষতা বজায় রাখে।
(iii) তড়িৎ বিশ্লেষ্য দুটিকে সছিদ্র দেয়ালের মাধ্যমে পৃথক করা হলে, দেয়ালের গায়ে একটি তরল সংযোগ বিভব সৃষ্টি হয়। ফলে এ কোষ থেকে কিছু পরিমাণ কম বিদ্যুৎ পাওয়া যায়। কিন্তু লবণ সেতু ব্যবহার করা হলে বা লবণ সেতুর মাধ্যমে কোষ তৈরি করা হলে এক্ষেত্রে তরল সংযোগ বিভব তৈরি হয় না বলেই তা থেকে অধিক পরিমাণ বিদ্যুৎ পাওয়া যায়। উল্লেখ্য যে, যখন দুটি তড়িৎ বিশ্লেষ্য দ্রবণ বা একই তড়িৎ বিশ্লেষ্যের দুটি ভিন্ন ঘনমাত্রার দ্রবণ পরস্পর সংস্পর্শে আসে তখন উভয়ের সংযোগস্থলে একটি বিভব পার্থক্য সৃষ্টি হয়। একে তরল সংযোগ বিভব বলে। এ বিভব দ্রুতগামী আয়নের বেগ হ্রাস করে তথা বিক্রিয়ার হার কমে ।
প্রশ্ন: তরল সন্ধি বিভব (Liquid Junction Potential) কি?(What is liquid Junction Potential?)
উত্তর:
ড্যানিয়্যাল কোষে দুটি তড়িৎবিশ্লেষ্যের দ্রবণকে অর্ধভেদ্য পর্দা দ্বারা পৃথকীকৃত অবস্থায় বিদ্যুৎ উৎপন্ন হতে থাকলে দুটি তড়িৎদ্বারের দুই প্রকোষ্ঠের আয়নসমূহ অর্ধভেদ্য পর্দার মধ্য দিয়ে অসম বেগে চলাচল করার কারণে দুই তরলের সংযোগস্থলে যে বিভব সৃষ্টি করে তাকে তরল সন্ধি বিভব (LJP) বলে। যদি ক্যাটায়ন, অ্যানায়ন অপেক্ষা দ্রুতগামী হয় তবে ক্যাটায়নটি অ্যানায়ন অপেক্ষা দ্রুত লঘু দ্রবণে পরিব্যপ্ত হয়। ফলে উক্ত দ্রবণটি ধীরে ধীরে অপেক্ষাকৃত বেশি ঘনমাত্রার দ্রবণের তুলনায় (+)ve চার্জ যুক্ত হয়ে পড়ে।
অপরদিকে অ্যানায়ন, ক্যাটায়ন অপেক্ষা দ্রুতগামী হয় তাহলে অপেক্ষাকৃত লঘু দ্রবনটি ঋণাত্মক চার্জযুক্ত হয়ে পড়ে। তাই দেখা যায় যে উভয় ক্ষেত্রেই উভয় দ্রবণের সংযোগ স্থলে একটি বৈদুতিক দ্বি-স্তর সৃষ্টি হয় এবং বিপরীত চার্জের আকর্ষণের জন্য একটি বিভব (Potential) পার্থক্য সৃষ্টি হয় যা LJP নামে পরিচিতি ।
প্রশ্ন: কীভাবে LJP দূর করে? (How to remove LJP?)
যেহেতু LJP সৃষ্ঠির জন্য অর্ধভেদ্য পর্দার পৃষ্ঠতল বরাবর আয়নসমূহের অসম বেগে চলাচল দায়ী সেহেতু ক্যাটায়ন ও অ্যানায়নের স্বাভাবিক চলাচল নিশ্চিত করে বা ভিন্ন ভিন্ন প্রকোষ্ঠের বিদ্যমান অতিরিক্ত চার্জকে সেখানেই প্রশমিত করার মাধ্যমে LJP হ্রাস করা হয় । লবণ সেতু ব্যবহার করে এ কাজটি করা হয়। যে আয়নসমূহ LJP সৃষ্টি করে লবণ সেতুতে উপস্থিত লবণ উক্ত আয়নসমূহের সাথে বিক্রিয়া করে আয়নসমূহের লবণ গঠন করে ফলে LJP প্রশমতি হয়। যেমন- Zn(s)∣ZnSO4(aq)∣∣CuSO4(aq)∣Cu(s)
LJP সৃষ্টির জন্য Zn2+ ও SO42− আয়ন দায়ী। তখন লবণ সেতুতে ব্যবহৃত লবণ (KCl) উক্ত আয়নদ্বয়ের সাথে বিক্রিয়া করে তাদের লবণ উৎপন্ন করে ফলে LJP প্রশমিত হয়।
Zn2++2Cl−→ZnCl2;SO42−+2 K+→K2SO4
প্রশ্নঃ একক তড়িৎদ্বার বিভব বলতে কী বুঝি?(What is single electrode potential?)
উত্তর:
তড়িৎ রাসায়নিক কোষের প্রত্যেকটি অর্ধকোষে তড়িৎ বিশ্লেষ্য এবং তড়িৎদ্বারের পৃষ্ঠতলে একটি নির্দিষ্ট বৈদ্যুতিক বিভব সৃষ্টি হয় তাকে ঐ তড়িৎদ্বারের একক তড়িৎদ্বার বিভব বলে ।
ব্যাখ্যা (Explanation): কোন তড়িৎদ্বার বা ধাতব দন্ডকে এর লবণের দ্রবণে নিমজ্জিত করলে ধাতব দন্ড হতে ধাতব পরমাণুগুলো আয়নাকারে দ্রবণে আসার প্রবণতা দেখায়। একে ঐ আয়নের দ্রবণ চাপ বলা হয়। আবার, দ্রবণের ধণাত্মক আয়নগুলো e– গ্রহণ করে পুনরায় ধাতব দন্ডে যুক্ত হতে চায়। একে ধাতব আয়নের অসমোটিক চাপ বলা হয়। এ দুটি বিপরীতমূখী প্রক্রিয়া কখনও সমান হয় না, এর ফলে ধাতব দন্ড এবং আয়নের সংস্পর্শ তলে একটি বৈদ্যুতিক বিভব সৃষ্টি হয়। একে তড়িৎদ্বারটির তড়িৎদ্বার বিভব বলে। যদি, দ্রবণ চাপ > অসমোটিক চাপ হয় তাহলে তড়িৎদ্বারটি অ্যানোড হিসেবে কাজ করে এবং অসমোটিক চাপ > দ্রবণ চাপ হলে তড়িৎদ্বারটি ক্যাথোড হিসেবে কাজ করে।
Zn দ্রবণ চাপ⇌অসমোটিক Zn2++2e−
প্রশ্নঃ জারণ বিভব ও বিজারণ বিভব বলতে কী বুঝ?(What is oxidation potential and reduction potential?)
উত্তর:
যে তড়িৎদ্বারে জারণ ঘটে তাকে অ্যানোড এবং অ্যানোডের বিভবকে জারণ বিভব বলে। অ্যানোড হতে দ্রবণে পরমাণুগুলো দ্রবণে আয়ন হিসেবে যাওয়ার প্রবণতার কারণে অ্যানোড ও দ্রবণের সংযোগ স্থলে যে বিভব সৃষ্টি হয়, তাকে জারণ বিভব বলে। যেমন- গ্যালভানিক কোষের অ্যানোড তড়িৎদ্বারের জারণ বিভব হল নিম্নরূপ :
Zn(s)→Zn2+(aq)+2e−;EZn/Zn2+=+0.76 V
যে তড়িৎদ্বারে বিজারণ ঘটে, তাকে ক্যাথোড এবং ক্যাথোডের বিভবকে বিজারণ বিভব বলে। দ্রবণ থেকে ধণাত্মক আয়নের ক্যাথোডে ইলেকট্রন গ্রহণের প্রবণতার কারণে ক্যাথোড এবং দ্রবণের সংযোগস্থলে যে বিভব উৎপন্ন হয়, তাকে বিজারণ বিভব বলে। যেমন: গ্যালভানিক কোষের বিজারণ বিভবের মান :
Cu2+(aq)+2e−→Cu(s);ECu2+/Cu=+0.34 V
উল্লেখ্য যে, কোন তড়িৎদ্বারের জারণ বিভব এবং বিজারণ বিভবের মান সমান কিন্তু বিপরীত চিহ্নযুক্ত হবে। [আয়ন আগে ধাতু পরে হলে বিজারণ বিভব এবং ধাতু আগে আয়ন পরে হলে জারণ বিভব বুঝায়।]
প্রশ্নঃ প্রমাণ তড়িৎদ্বার বিভব বলতে কী বুঝ? (What is standard electrode potential?)
উত্তর:
তড়িৎ রাসায়নিক কোষের কোন অর্ধকোষের তড়িৎদ্বার যে তড়িৎ বিশ্লেষ্য বা আয়নে দ্রবণে নিমজ্জিত থাকে সে দ্রবণের ঘনমাত্রা 1M, তাপমাত্রা 25°C এবং গ্যাসীয় তড়িৎদ্বারের ক্ষেত্রে 1 atm চাপে বুদবুদ আকারে গ্যাস চালনা করা হলে প্রাপ্ত তড়িৎদ্বার বিভবকে প্রমাণ তড়িৎদ্বার বিভব বলে।
প্রশ্নঃ Cu এর প্রমাণ তড়িৎদ্বার বিভব +0.34V বলতে কী বুঝ? (What is +0.34V standard electrode potential of Cu?)
উত্তর:
25°C তাপমাত্রায় 1M ঘনমাত্রার CuSO4 দ্রবণে Cu দন্ড নিমজ্জিত করে প্রাপ্ত অর্ধকোষকে প্রমান H2 তড়িৎদ্বারের সাথে যুক্ত করে যে কোষ পাওয়া যায় তার emf এর মান হচ্ছে +0.34V.
প্রশ্ন : নির্দেশক তড়িৎদ্বার বা Reference তড়িৎদ্বার বলতে কী বুঝ? (What is reference electrode?)
উত্তর:
কোন তড়িৎদ্বারের বিভব মান পরিমাণ করতে হলে, একে অবশ্যই একটি প্রমাণ তড়িৎদ্বারের সাথে যুক্ত করে সম্পূর্ণ কোষ তৈরি করতে হয়। ঐ কোষের EMF মানই পরীক্ষাধীন তড়িৎদ্বারের বিভব মান নির্দেশ করে। এক্ষেত্রে ব্যবহৃত প্রমাণ তড়িৎদ্বারটিকে নির্দেশক বা Reference তড়িৎদ্বার বলে।
যেমন- (i) H2 তড়িদ্বার, (ii) ক্যালোমেল তড়িৎদ্বার ।
উল্লেখ্য যে, প্রমাণ তড়িৎদ্বারের বিভবের মান স্বেচ্ছাকৃতভাবে শূন্য ধরা হয়। নির্দেশক তড়িৎদ্বার দু’প্রকার।
প্রাইমারি বা মুখ্য নির্দেশক তড়িৎদ্বার (Primary Reference electrode) :
প্রমাণ হাইড্রোজেন তড়িৎদ্বারকে (Standard Hydrogen electrode S.H.E) প্রাইমারি বা মুখ্য নির্দেশক তড়িৎদ্বার বলা হয়। কারণ হাইড্রোজেন তড়িৎদ্বার (S.H.E) দ্বারা অন্যান্য তড়িৎদ্বারের প্রমাণ বিভব নির্ণয় করা হয়।

সেকেন্ডারি বা গৌণ নির্দেশক তড়িৎদ্বার (Secondary Reference Electrode):
দৈনন্দিন বিভিন্ন ইলেকট্রোডের বিভব মাপার জন্য প্রাইমারি নির্দেশক তড়িৎদ্বার রূপে প্রমাণ H- তড়িৎদ্বার (S.H.E) ব্যবহার করা সুবিধাজনক নয়। কারণ এর মধ্যে (১)25°C তাপমাত্রায় সব সময় HCl দ্রবণের ঘনমাত্রা 1.0M রাখা যায় না; এবং (২) ঐ HCl দ্রবণে 1atm চাপে বিশুদ্ধ H2গ্যাস চালনা করা সম্ভব হয় না। তাই S.H.E এর পরিবর্তে S.H.E দ্বারা সঠিকভাবে নির্ধারিত তড়িৎ বিভব যুক্ত কিছু ধাতু ও ধাতুর অদ্রবণীয় লবণ তড়িৎদ্বার বা অর্ধকোষকে প্রয়োগ ক্ষেত্রে ব্যবহার করা হয়। এরূপ তড়িৎদ্বার যুক্ত মধ্যকোষকে সেকেন্ডারি বা গৌণ নির্দেশক তড়িৎদ্বার বলে। যেমন-
- i) ক্যালোমেল তড়িৎদ্বার Hg(l),Hg2Cl2(s)∣Cl−(aq)
- ii) সিলভার-সিলভার ক্লোরাইড তড়িৎদ্বার ∣Ag(s),AgCl(s)∣Cl−(aq)
প্রশ্ন: প্রমাণ H2 তড়িৎদ্বার বলতে কী বুঝ? (What is standard H2 electrode?)
উত্তর:
1M ঘনমাত্রার H+ আয়নের দ্রবণে Pt গুড়ার আস্তরণ যুক্ত Pt পাত রেখে এর মধ্যে 25°C তাপমাত্রায় এবং 1 atm চাপে বুদবুদ আকারে বিশুদ্ধ H2 গ্যাস চালনা করা হলে সৃষ্ট তড়িৎদ্বারকে H2 তড়িৎদ্বার প্রকাশ করা হয়।
21H2(g)⇋H++e− এ তড়িৎদ্বারকে নিমরূপে প্রকাশ করা যায়।
Pt,H2( gas )(1 atm)/H+(1M);E0=0V
তড়িৎ কোষে সংযুক্ত অবস্থায় H2 তড়িৎদ্বার অ্যানোড না ক্যাথোড হবে তা নির্ভর করে কোষের অপর তড়িৎদ্বারের বিজারণ বিভবের উপর। যদি অপর তড়িৎদ্বারের বিজারণ বিভবের মান H2 তড়িৎদ্বারের চেয়ে কম হয় তাহলে H2 তড়িৎদ্বার হবে ক্যাথোড এবং এর বিপরীত হলে H2 তড়িৎদ্বার হবে অ্যানোড।
তড়িৎদ্বার অ্যানোড হলে: Pt,H2(1.0 atm)/H+(1.OM);E∘=0.0 Volt
21H2⇋H++e−
তড়িৎদ্বার ক্যাথোড হলে: H+(1.0M)/H2(1.0 atm),Pt
H+(aq)+e−⇋21H2(g)
প্রশ্ন: প্রমাণ হাইড্রোজেন তড়িৎদ্বারের বিভব শূন্য কেন? (Why is the standard hydrogen electrode potential zero?)
উত্তর:
25°C তাপমাত্রায় 1.0atm চাপে বিশুদ্ধ হাইড্রোজেন গ্যাসকে 1.0M HCl এসিডের দ্রবণে অনবরত চালনা করলে প্রমাণ হাইড্রোজেন তড়িৎদ্বার সৃষ্টি হয়। সেহেতু হাইড্রোজেন একটি গ্যাসীয় পদার্থ তাই তড়িৎপ্রবাহের সংযোগের জন্য নিষ্ক্রিয় ধাতু প্লাটিনামের পাত এসিড দ্রবণে রাখা হয়। এ প্লাটিনামের চারপাশ দিয়ে বুদবুদ আকারে হাইড্রোজেন গ্যাস অনবরত চালনা করা হয়।
সুতরাং তড়িৎদ্বারটি হল: Pt,H2(1.0 atm)/H+(1.OM)
এ তড়িৎদ্বারের উপরিতলে নিম্নলিখিত উভমুখী বিক্রিয়া সংঘটিত হয়।
H+(aq)+e⇋21H2(g)
তড়িৎ কোষে ব্যবহৃত কোনো তড়িৎদ্বারের বিভব গণনার সুবিধার্থে মুখ্য নির্দেশক হিসেবে প্রমাণ হাইড্রোজেন তড়িৎদ্বারের সঙ্গে সংযোগ করা হয়। প্রমাণ হাইড্রোজেনের তড়িৎদ্বারের বিভবের মানকে সর্বসম্মতিক্রমে শূন্য ধরা হয়। যেহেতু পূর্ণ তড়িৎকোষের তড়িচ্চালক বল, তড়িৎকোষের ব্যবহৃত দুটি তড়িৎদ্বারের বিভবের সমষ্টির সমান, তাই এক্ষেত্রে তড়িৎকোষের তড়িচ্চালক বলই অজানা তড়িৎদ্বারের বিভবের মান। প্রমাণ হাইড্রেজেনের তড়িৎদ্বারের বিভবের মান শূন্য হলেও তার মানে এই নয় যে, হাইড্রোজেন তড়িৎদ্বারের হাইড্রোজেন ইলেকট্রন ছেড়ে বা গ্রহণের প্রবণতা নেই বা শূন্য। অবশ্যই এ ক্ষেত্রে হাইড্রোজেনের ইলেকট্রন ছেড়ে দেয়া বা গ্রহণ করার প্রবণতা আছে। কিন্তু গণনার সুবিধার্থে বিভবের মান শূন্য ধরে অন্যান্য তড়িৎদ্বারের বিভবের মান নির্ণয় করা হয়।
প্রশ্ন: ক্যালোমেল তড়িৎদ্বার কি?(What is calomel electrode?)
উত্তর:
প্রকৃত পক্ষে হাইড্রোজেন তড়িৎদ্বার ব্যবহার করা খুব একটা সুবিধাজনক নয় বিধায় সেকেন্ডারি নির্দেশক তড়িৎদ্বার উদ্ভাবন করা হয়েছে। হাইড্রোজেন তড়িৎদ্বারের সঙ্গে তুলনা করে এই সেকেন্ডারি নির্দেশক তড়িৎদ্বারের বিভব সঠিকভাবে নির্ণয় করা হয়। যে সমস্ত তড়িৎদ্বার সেকেন্ডারি নির্দেশক হিসেবে ব্যবহৃত হয় তার মধ্যে ক্যালোমেল তড়িৎদ্বার উল্লেখযোগ্য। নিচে একটি ক্যালোমেল তড়িৎদ্বার দেখানো হল:
ক্যালোমেল তড়িৎদ্বারের পাশে একটি সরু নলসহ একটি চওড়া কাচের নলে কিছু পরিমাণ পারদ নিয়ে তার উপর কঠিন মারকিউরাস ক্লোরাইড (Hg2Cl2) লবণ বা ক্যালোমেল নেয়া হয়। এরপর চওড়া কাচের নলটি KCl এর সম্পৃক্ত দ্রবণ দ্বারা পূর্ণ করা হয়। বৈদ্যুতিক সংযোগের জন্য প্লাটিনামের একটি সরু তার তরল পারদের মধ্যে প্রবেশ করানো থাকে। পটাশিয়াম ক্লোরাইডের দ্রবণসহ পাশের নলটি তড়িৎ কোষের লবণ সংযোগকারী হিসেবে কাজ করে। এখানে উল্লেখ্য, দুটি ভিন্ন ঘনমাত্রায়, লবণের দ্রবণ এক হলে সংযোগ স্থানে এক ধরনের বিভবের সৃষ্টি হয় যা তড়িৎদ্বার বিভব সঠিকভাবে গণনার ক্ষেত্রে জটিলতা সৃষ্টি করে। এই জটিলতা দূর করার জন্য লবণ সেতু ব্যবহার করা হয়। ক্যালোমেল তড়িৎদ্বারে নিচের বিক্রিয়াটি সংঘটিত হয়।
ক্যালোমেল ইলেকট্রোড (Calomel Electrode):
Hg,Hg2Cl2( s)/Cl (যখন এটি ক্যাথোড হিসেবে ব্যবহৃত হয়)
Hg2Cl2+2e⇋2Hg(l)+2Cl
প্রশ্ন : কোষের EMF বা তড়িৎচ্চালক বল বলতে কী বুঝ?(What is EMF or electromotive force?)
উত্তর:
কোন তড়িৎ রাসায়নিক কোষের দুটি তড়িৎদ্বারের বিভব পার্থক্যকে ঐ কোষের EMF বলা হয় বা যে বিভব পার্থক্যের কারণে এক তড়িৎদ্বার থেকে অন্য তড়িৎদ্বারে বিদ্যুৎ প্রবাহিত হয় তাকে কোষটির EMF বলে ।
কোন কোষের EMF বা Ecell = অ্যানোডের জারণ বিভব (Eox) + ক্যাথোডের বিজারণ বিভব (Ered)
= অ্যানোডের জারণ বিভব – ক্যাথোডের জারণ বিভব
= ক্যাথোডের বিজারণ বিভব – অ্যানোডের বিজারণ বিভব
প্রশ্ন : কোন তড়িৎ রাসায়নিক কোষে কিভাবে অ্যানোড এবং ক্যাথোড নির্ধারিত হয়? (How are the anode and cathode defined in an electrochemical cell?)
উত্তর:
(i) দুটি তড়িৎদ্বারের মধ্যে যে তড়িৎদ্বার সক্রিয়তা সিরিজের উপরে অবস্থান করে, সেটি হবে অ্যানোডে এবং নিচে অবস্থানকারী অপর তড়িৎদ্বারটি হবে ক্যাথোড।
(ii) দুটি তড়িৎদ্বারের জারণ বিভবের মান দেয়া থাকলে যে তড়িৎদ্বারের জারণ বিভবের মান বেশি হবে, সেটি হবে অ্যানোডে। অপরটি হবে ক্যাথোড। একইভাবে দুটি তড়িৎদ্বারের বিজারণ বিভবের মান দেয়া থাকলে যে তড়িৎদ্বারের বিজারণ বিভবের মান বেশি হবে সেটি হবে ক্যাথোড। অপরটি হবে অ্যানোড।
প্রশ্ন : কোন তড়িৎ রাসায়নিক কোষের স্বতঃস্ফূর্ততা কীরূপে নির্ধারণ করা হয়? (How is the spontaneity of an electrochemical cell defined?)
উত্তর:
কোন কোষের EMF এর মান ধণাত্মক হলে, ঐ কোষের বিক্রিয়া স্বতঃস্ফূর্ত হবে। অর্থাৎ কোষটি বিদ্যুৎ উৎপাদনে সক্ষম হবে। কিন্তু, EMF এর মান ঋণাত্মক হলে কোষ বিক্রিয়া স্বতঃস্ফূর্ত হবে না অর্থাৎ কোষটির বিদ্যুৎ উৎপাদন সম্ভব হবে না।
দেওয়া আছে,
EB/B20=−0.8 VEA/A2∘=+0.44 V
- দুটি তড়িৎদ্বারের সমন্বয়ে একটি কোষ তৈরি কর। কোষ বিক্রিয়া লিখ। ঐ কোষের EMF মান নির্ণয় কর।
- Make a cell combining two electrodes. Write the cell reaction. Define the EMF value of that cell.)
প্রদত্ত জারণ বিভবের মান হতে দেখা যায় যে, B তড়িৎদ্বারটি হবে ক্যাথোড এবং A তড়িৎদ্বারটি হবে অ্যানোড।
কারণ A তড়িৎদ্বারের জারণ বিভবের মান B তড়িৎদ্বার অপেক্ষা বেশি।
দুটি তড়িৎদ্বারের সমন্বয়ে গঠিত কোষ হবে নিম্নরূপ-
A(s)∣∣A2+(aq)∣∣B2+(aq)∣B(s) বা, A(s)∣∣A2+(aq)∣∣∣∣B2+(aq)∣∣B(s)
অ্যানোড: A→A2++2e−
ক্যাথোড: B2++2e−→B
বিক্রিয়া : A+B2+→B+A2+ (মোট বিক্রিয়া)
কোষটির EMF বা Ecell =A তড়িৎদ্বারের জারণ বিভব – B তড়িৎদ্বারের জারণ বিভব
=EA/A2+o−EB2+/Bo=+0.44+0.8=+1.24
যেহেতু EMF এর মান ধণাত্মক তাই কোষ বিক্রিয়া স্বতঃস্ফূর্ত ঘটবে।
- নিমোক্ত কোষের বিক্রিয়াটি স্বত:স্ফূর্তভাবে ঘটবে কি?(Will the following reaction take place independently?)
B∣∣B2+∣∣A2+∣A
কোষটির EMF বা Ecell=B তড়িৎদ্বার জারণ বিভব – A তড়িৎদ্বারের জারণ বিভব
=EB2+/Bo−EA/A2+o=−0.8−0.44=−1.24
EMF negative, তাই স্বত:স্ফূর্ত হবে না।
দেওয়া আছে,
EB/B2∘=+0.76 VEC/C2+0=−0.34 V B+CSO4→BSO4+C
বিক্রিয়াটি স্বতঃস্ফূর্তভাবে হবে কিনা? তা যাচাই কর।
এ বিক্রিয়াটি নিম্নরূপে প্রকাশ করা যায়:
B+C2+→B2++C
এ বিক্রিয়াটি যে কোষে সংঘঠিত হয় তাকে নিম্নরূপে প্রকাশ করা যায়।
B∣∣B2+∣∣C2+∣C
অ্যানোড: B→B2++2e−
ক্যাথোড: C2++2e→C
∴ এ কোষে EMF = EB/B2+−EC/C2+
=0.76+0.34
=1.1V
যেহেতু EMF এর মান ধণাত্মক তাই কোষ বিক্রিয়া স্বতঃস্ফূর্তভাবে সংঘটিত হবে। অর্থাৎ বিক্রিয়াটি স্বত:স্ফূর্তভাবে সংঘটিত হবে।
২য় পদ্ধতি (2nd method): প্রদত্ত জারণ বিভবের মান হতে দেখা যায়, B তড়িৎদ্বারের জারণ বিভবের মান C তড়িৎদ্বার অপেক্ষা বেশি হবে। তাই, C অপেক্ষা B শক্তিশালী বিজারক হবে। এ কারণে B মৌল C2+ আয়নকে বিজারিত করতে পারে। অর্থাৎ বিক্রিয়াটি স্বতঃস্ফূর্ত সংঘটিত হবে।
দেয়া আছে,
EZn2+/Zn0=−0.76 VEPd2+/∘Pd=−0.126 V
উভয় দ্রবণের ঘনমাত্রা একই হলে, Pd ধাতু দ্বারা Zn2+ কে বিজারিত করা যাবে কী? (If the concentration of both solution is same, will Zn2+ be reduced by Pd metal?)
১ম পদ্ধতি (1st method):
যদি Pd ধাতু দ্বারা Zn2+ বিজারিত হয় তাহলে নিম্নোক্ত বিক্রিয়া সংঘটিত হবে।
Pd+Zn2+→Pd2++Zn
এ বিক্রিয়াটি যে কোষে সংঘটিত হয়, তাকে নিম্নরূপে প্রকাশ করা যায়-
Pd∣∣Pd2+∣∣Zn2+∣Zn
এ কোষের EMF বা Ecell =EZn2+/Zn−EPd2+/Pd
=0.76+0.126 = − 0.634V
যেহেতু, কোষের EMF এর মান ঋণাত্মক তাই বিক্রিয়াটি স্বতঃস্ফূর্ত হবে না। অর্থাৎ Pd ধাতু Zn2+ কে বিজারিত করতে পারে না ।
২য় পদ্ধতি (2nd method):
সক্রিয়তা সিরিজে Pd অপেক্ষা Zn উপরের অবস্থান করে। তাই Zn অধিক শক্তিশালী বিজারক এক্ষেত্রে Zn, Pd2+ কে বিজারিত করতে পারলেওPd, Zn2+ কে বিজারিত করতে পারে না।
প্রশ্ন: Zn এর পাত্রে FeSO4 দ্রবণ রাখা যাবে কী?(CanFeSO4 be kept in the container of Zn?) / (Can we keepFeSO4 solution in Zinc container?)
উত্তর :
দেওয়া আছে,
EZn∘Zn2=+0.76 V এবং, EFe/Fe2+∘=+0.44 V
- এ ধরনের সমস্যাবলীতে পাত্রকে অ্যানোড ধরে বিক্রিয়াটি বিবেচনা করতে হবে এবং কোষ গঠন করতে হবে।
- সাধারণত অধিক সক্রিয় ধাতুর পাত্রে কম সক্রিয় ধাতুর দ্রবণ রাখা যাবে না।
Zn এর পাত্রে FeSO4 দ্রবণ রাখা হলে, যদি বিক্রিয়া সংঘটিত হয় তবে একে নিমরূপে প্রকাশ করা যায়-
Zn+FeSO4→ZnSO4+FeZn+Fe2+→Zn2++Fe
এ বিক্রিয়াটি যে কোষে সংঘটিত হয় তা হলে,
Zn∣∣Zn2+∣∣Fe2+∣Fe
এ কোষের EMF বা Ecell=E∘nn/Zn2+−EFe/Fe2+∘
= 0.76 − 0.44 = 0.32
যেহেতু, EMF এর মান ধণাত্মক। তাই কোষ বিক্রিয়া স্বতঃস্ফূর্ত হবে। এ কারণে Zn এর পাত্রে FeSO4 দ্রবণ রাখা যাবে না । অর্থাৎ Zn, Fe2+ কে বিজারিত করতে পারে বলেই বিক্রিয়াটি স্বতঃস্ফূর্ত হবে। কারণ সক্রিয়তা সিরিজে Zn, Fe এর উপরে অবস্থান করে।
প্রশ্ন: তুঁতের দ্রবণে Ag চূর্ণ যোগ করা হলে কোন পরিবর্তন ঘটে না। তবে, AgNO3 দ্রবণে Cu চূর্ণ যোগ করলে দ্রবণ থেকে ধূসর সিলভার অধঃক্ষিপ্ত হয় কেন? (If solid Ag is added to CuSO4 solution, no reaction takes place. However, if solid Cu is added to AgNO3 solution, why Ag is precipitated?)
উত্তর :
CuSO4(aq)+Ag(s)→ বিক্রিয়া ঘটে না
2AgNO3(aq)+Cu(s)→Cu(NO3)2(aq)+2Ag↓
অর্থাৎ কপার AgNO3 দ্রবণ থেকে Ag কে প্রতিস্থাপন করে।
সুতরাং সক্রিয়তার ক্রম হল- Cu>Ag
(ii) তুঁতের দ্রবণে Fe চূর্ণ যোগ করলে Cu এর লাল অধঃপড়ে।
CuSO4(aq)+Fe→FeSO4(aq)+Cu(s)∴Fe>Cu
(iii) FeSO4 দ্রবণে Zn চূর্ণ যোগ করলে Fe এর কালো অধঃক্ষেপ পড়ে।
FeSO4(aq)+Zn(s)→ZnSO4(aq)+Fe(s)
সুতরাং ৪টি পরীক্ষার সামগ্রিক সিদ্ধান্ত হল সক্রিয়তা সিরিজে ধাতুসমূহের সক্রিয়তার উচ্চ ক্ৰম সক্রিয়তা:
Ag কোন কোষের EMF এর মান তড়িৎদ্বারের প্রকৃতি, তাপমাত্রা এবং ঘনমাত্রার উপর নির্ভর করে। যদি কোন তড়িৎ রাসায়নিক কোষের দুটি তড়িৎ বিশ্লেষ্যের ঘনমাত্রা ভিন্ন হয় তাহলে নার্নষ্ট সমীকরণ ব্যবহার করে ঐ কোষের EMF মান নির্ণয় করা যায়। সমীকরণ নিম্নরূপে প্রতিষ্ঠা করা যায়- তড়িৎ রাসায়নিক কোষে বিক্রিয়ার ফলে পরিবাহীর মধ্য দিয়ে যখন বিদ্যুৎ প্রবাহ সংঘটিত হয় তখন কোষটি বৈদ্যুতিক কাজ সম্পন্ন করে। মনে করি, কোনো কোষের তড়িৎচ্চালক বল E এবং কোষের রিডক্স বিক্রিয়ায় n সংখ্যক ইলেকট্রন প্রয়োজন হয়। ফলে পরিবাহীতে n ফ্যারাডে (nF) তড়িৎ প্রবাহিত হয়। সুতরাং তড়িৎ প্রবাহ জনিত মোট কাজের পরিমাণ =nF কুলম্ব ×E ভোল্ট = nFE জুল তাপগতিবিদ্যার নিয়ম অনুযায়ী, তড়িৎ কোষে বিক্রিয়ার ফলে যে মুক্তশক্তির হ্রাস ঘটে, তা তড়িৎ প্রবাহ জনিত কাজের সমান, অর্থাৎ −ΔG=nFE [ΔG এর মান ঋণাত্মক হলে কোষ বিক্রিয়া স্বতঃস্ফূর্ত হবে কিন্তু EMF ধণাত্মক হলে কোষ বিক্রিয়া স্বতঃস্ফূর্ত হবে, ΔG=0 এবং Emf=0 হলে কোষ বিক্রিয়া সাম্যাবস্থায় থাকে] গিবস এর সমীকরণ মতে, ΔG=ΔG∘+RTlnk−nFE=−nFE0+RTInkE=E0−nFRTlnkE=E0−nF2.303RTlog[ বিক্রিয়ক আয়ন] [ উৎপাদ আয়ন] এ সমীকরণকে নার্নষ্ট সমীকরণ বলে। যার সাহায্যে কোন কোষের EMF মান নির্নয় করা যায়। যদি, T=25°C বা 298K হয় R=8.314JK−1 mol−1n=2 হয়। F=96500C তাহলে, উপরোক্ত সমীকরণটিকে নিম্নরূপে লেখা যায়- E=E0−20.0592log[বিক্রিয়ক আয়ন] [উৎপাদ আয়ন] বা, Ecell =Ecell 0−20.0592logK এখানে K হল সাম্যধ্রুবক। পাতলা দ্রবণের জন্য নার্নস্ট সমীকরণে সরাসরি আয়নের ঘনমাত্রা ব্যবহার করা যায় । কিন্তু ঘন দ্রবণের ক্ষেত্রে Activity co-cfficient এর মান 1 এর সমান হয় না বলে সেক্ষেত্রে সরাসরি ঘনমাত্রা ব্যবহার করে কোষ বিভব পরিমাপ করা যায় না। অন্যদিকে, ঘন দ্রবণের ক্ষেত্রে বিপরীত চার্জের আয়নসমূহের মধ্যে দুর্বল আকর্ষণ বল কাজ করে। তাই জারণ ও বিজারণে অংশ নেয়া মুক্ত আয়নের পরিমাণও কমে যায়। তাই বেশি ঘনমাত্রার (10−3M এর বেশি) দ্রবণের কোষ বিভব সম্পর্কে নার্নস্ট সমীকরণ সঠিক ধারণা দিতে পারে না। অর্থাৎ নার্নস্ট সমীকরণ মূলত পাতলা দ্রবণের জন্যই প্রযোজ্য। Mg∣∣Mg2+(0.13M)∣∣Ag+(1×10−4M)∣AgE∘Mg/Mg2+=+2.34V,E∘Ag/Ag2+=−0.8V উপরোক্ত তড়িৎ কোষ সংঘটিত বিক্রিয়া নিম্নরূপ : Mg→Mg2++2e−Mg+2Ag+→2eMg2++2Ag[Ag++e−→Ag]×2 যেহেতু, এখানে 2mole− আদান প্রদান হয়েছে এবং তাপমাত্রা 25°C তাই নার্নষ্ট সমীকরণটিকে নিম্নরূপে লেখা যায়- E=E0−20.0592log[Ag2+]2[Mg2+]=[E0Mg/Mg2+−E0Ag/Ag2+]−20.0592log(1×10−4)20.13=(2.34+0.8)−20.0592log(1×10−4)20.13=+2.96 V তড়িৎ রাসায়নিক সারি(Electrochemical Series) এক প্রকোষ্ঠ বিশিষ্ট তড়িৎ রাসায়নিক কোষের উদাহরণ হল, তড়িৎ বিশ্লেষ্য কোষ যা সাধারণত ধাতু নিষ্কাশনে এবং তড়িৎ বিশ্লেষণে ব্যবহৃত হয়। দুই প্রকোষ্ঠ বিশিষ্ট তড়িৎ রাসায়নিক কোষ হল: গ্যালভানিক কোষ এ ধরনের কোষ বিদ্যুৎ উৎপাদনে ব্যবহৃত হয়। যে রাসায়নিক কোষে একটি মাত্র তরল ব্যবহৃত হয় তাকে তরল কোষ বলে। যেমন- লেকল্যান্স কোষ এবং যে কোষে দুটি তরল ব্যবহৃত হয় তাকে দুই তরল কোষ বলে। যেমন- গ্যালভানিক কোষ। তবে শুষ্ক কোষে কোনো তরল পদার্থ ব্যবহৃত হয় না। ধাতু ক্ষয়ের অন্যতম উদাহরণ হল লোহার মরিচা পড়া। সাধারণত অবিশুদ্ধ লোহায় দ্রুত মরিচা পড়ে। এক্ষেত্রে অবিশুদ্ধ লোহার আয়রন অ্যানোড হিসেবে কাজ করে এবং ভেজালগুলো ক্যাথোড হিসেবে কাজ করে। যা নিষ্ক্রিয় তড়িৎদ্বার হিসেবে ব্যবহৃত হয়। আয়রন নিম্নরূপে আর্দ্র Fe2O3 গঠন করে। যা মরিচা হিসেবে পরিচিত। তাই বলা যায়, ধাতুর ক্ষয় একটি অ্যানোডিক জারণ প্রক্রিয়া। অ্যানোড (Anode) : Fe→Fe2++2e− ক্যাথোড (Cathode) : H2O+21O2+2e−→2OH−Fe2++2OH−→Fe(OH)2Fe(OH)2+21O2+H2O→Fe2O3⋅3H2Oপ্রশ্ন : নার্নষ্ট সমীকরণ প্রতিষ্ঠা কর। (Establish the Nernst’s Equation.)
উত্তর :
প্রশ্ন: নার্নস্ট সমীকরণের সীমাবদ্ধতা কী? (What are the limitations of Nernst’s equation?)
উত্তর :
প্রশ্নঃ 25°C তাপমাত্রায় নিম্নোক্ত কোষের EMF এর মান নির্ণয় কর। (Define the EMF value of the following cell at 25°C temperature.)
উত্তর :
প্রশ্নঃ H2 তড়িৎদ্বারের সংপেক্ষ বিভিন্ন তড়িৎদ্বারের বিজারণ বিভবের মান:-(Values of reduction potential of different electrode related toH2 electrode:)
উত্তর :
তড়িৎদ্বার অর্ধকোষ বিক্রিয়া প্রমাণ বিজারণ বিভব E0 (V) Li+/Li(s)K+/K(s)Ca2+/Ca(s)Na+/Na(s)Mg2+/Mg(s)Al3+/Al(s)Zn2+/Zn(s)Fe2/Fe(s)Sn2+/Su(s)Pb2+/Pb(s)H+/H2( g),PtCl−/AgCl(s),AgCl−/Hg2Cl2( s),HgCu2+/Cu(s)+0.28+0.34Ag+/Ag(s)Br−/Br2,PtCl−/Cl2,PtAu3+/Au Li++e→Li(s)K++e→K(s)Ca2++2e→Ca(s)Na4+e→Na(s)Mg2++2e→Mg(s)Al3++3e→Al(s)Zn2++2e→Zn(s)Fe2++2e→Fe(s)Sn2++2e→Su(s)Pb2++2e→Pb(s)H++e→21H2( g)AgCl+e−→Ag+Cl−Hg2Cl2+2e−→2Hg+2Cl−Cu2++2e−→Cu(s)I2+2e→2I−(aq)Hg2++2e−→Hg(I)Ag+e→Ag(s)Br2+2e→2Br−(aq)Cl2+2e→2Cl−(aq)Au3++3e→Au −3.05−2.93−2.87−2.71−2.37−1.66−0.76−0.44−0.14−0.130.00+0.22+0.54+0.79+0.80+1.08+1.36+1.50 প্রশ্নঃ এক প্রকোষ্ঠ এবং দুই প্রকোষ্ঠ বিশিষ্ট তড়িৎ রাসায়নিক কোষ বলতে কী বুঝ? (What is electrochemical cell with single & double compartments?)
উত্তর :
প্রশ্ন: এক তরল বিশিষ্ট কোষ এবং দুই তরল বিশিষ্ট কোষ বলতে কী বুঝ?(What is cell with single & double liquids?)
উত্তর :
প্রশ্ন : ধাতুর ক্ষয় একটি তড়িৎ রাসায়নিক প্রক্রিয়া, ব্যাখ্যা কর।(Explain- “Metallic corrosion is an electrochemical process”.)
উত্তর :
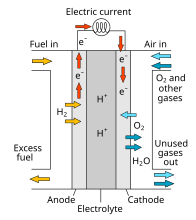
ফুয়েল সেল হচ্ছে এমন একটি তড়িৎ রাসায়নিক কোষ যেখানে হাইড্রোজেন এবং অক্সিজেনের বিক্রিয়ায় সরাসরি ডিসি কারেন্ট হয় এবং বাই প্রোডাক্ট হিসেবে পানি এবং তাপ উৎপন্ন হয়। অন্যান্য সাধারণ তড়িৎ রাসায়নিক কোষের মতো ফুয়েল সেলেও অন্যোড এবং ক্যাথোডের মাঝে ইলেক্ট্রোলাইট থাকে। এর গঠন অনেকটা স্যান্ডউইচের মতো। অন্যোডে হাইড্রোজেন ভেঙ্গে তৈরি হয় প্রোটন (H+) এবং ইলেকট্রন (e-)। প্রোটনটি ইলেক্ট্রোলাইটের মধ্য দিয়ে ক্যাথোডে গিয়ে অক্সিজেনের সাথে মিশে তৈরি করে পানি। আর এই ইলেকট্রনের চলাফেরায় তৈরি হয় বিদ্যুত।
প্রকারভেদ
ফুয়েল সেল বিভিন্ন প্রকারের হয়ে থাকে।[১] তাদের মধ্যে উল্লেখ্য হলঃ
- প্রোটোন বিনিময়কারী ফুয়েল সেল
- প্রত্যক্ষ ব্যবহৃত মিথানল ফুয়েল সেল অথবা মিথানল ফুয়েল সেল,
- সলিড অক্সাইড ফুয়েল সেল
- বিগলিত কার্বনেট ফুয়েল সেল
- এলকালাইন বা ক্ষারধর্মী ফুয়েল সেল
রাসায়নিক বিক্রিয়া
ফুয়েল সেলে সংগঠিত রাসায়নিক বিক্রিয়া হচ্ছেঃ
ফুয়েল সেল
- অ্যানোডঃ 2H2=4H+ + 4e-
- ক্যাথোডঃ O2+4H++4e-=2H2O
- নীট বিক্রিয়াঃ 2H2+O2=2H2O
একটি সাধারণ ফুয়েল সেলে উৎপাদিত বিভব শক্তির পরিমাণ ০.৭ ভোল্ট।
pH মিটার হলো কোন দ্রবণের প্রকৃতি( অম্লীয় না ক্ষারীয় বা প্রশম) এবং অম্লীয় ও ক্ষারীয় মাত্রা পরিমা্পক যন্ত্র।
কোন দ্রবণের- pH <7 হলে এটি অম্লীয় ; pH =7 হলে এটি প্রশম ; pH >7 হলে এটি ক্ষারীয় প্রকৃতির হয়।
কোন দ্রবণে বিদ্যমাব হাইড্রোজেন আয়নের মোলার ঘনমাত্রার ঋণাত্মক লগারিদমের মান কে pH বলে।
pH=-log[H^+]
Promotion